光合成色素合成・分解
17/05/24 18:40
光合成色素の合成・分解に関わる酵素群
紅藻やラン藻などの光合成生物では、光合成装置や光捕集装置にテトラピロール色素が存在し、これらが機能してはじめて効率的な光合成が可能になります。 これらの色素合成代謝は、実は未だに未解明な部分が多く残されています。私は、色素合成・分解に関わる幾つか鍵酵素に焦点を合わせ、その機能・反応メカニズムに迫るべく研究を進めてきました。
バクテリオクロロフィルc; 生合成に関与するメチル基転移酵素のメチル化機構
[J. Mol. Biol., 360, 839-849 (2006)]
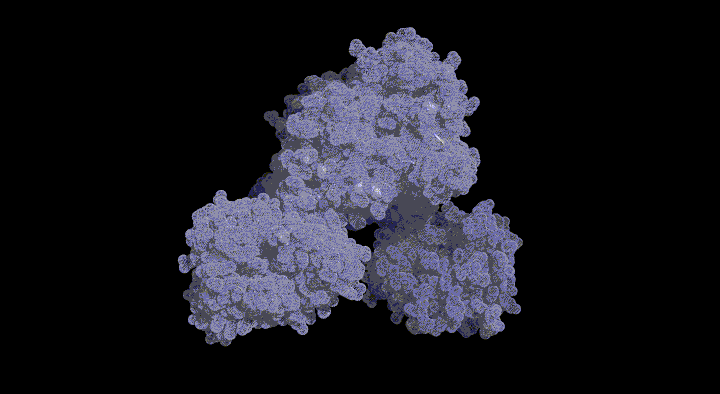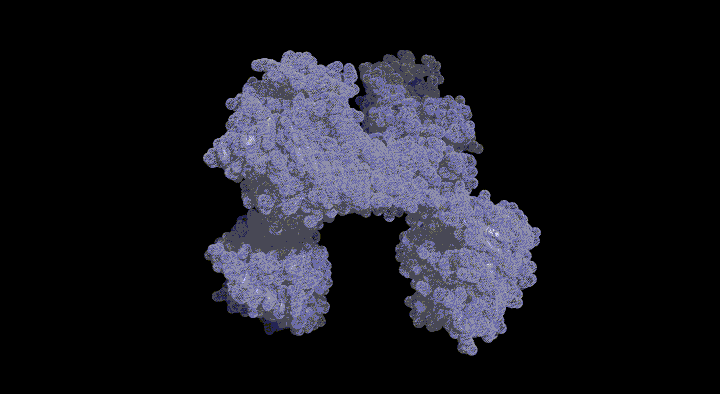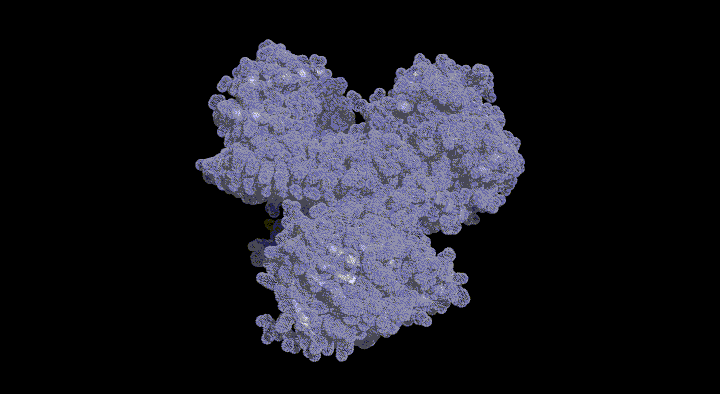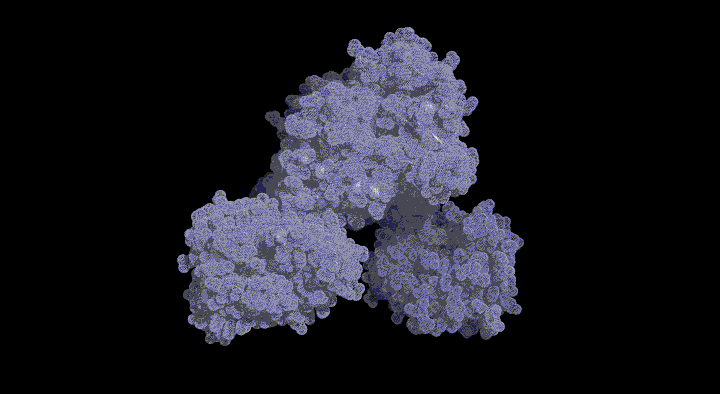
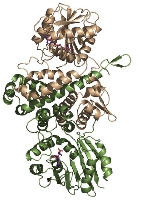
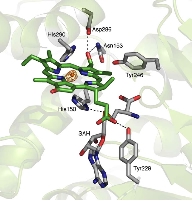
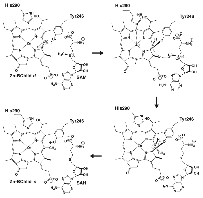
緑色硫黄光合成細菌は膜外アンテナ系としてクロロゾームを持つ。Chlorobium tepidumはクロロゾーム内の色素として バクテリオクロロフィルcを持ち、 近年行われたゲノム解析と分子遺伝学的手法からその生合成経路が明らかになりつつあります。この経路で BchU は、S-adenosylmethionine (SAM) をメチル基供与体として 20 位をメチル化する酵素(メチル基転移酵素) として同定されました。これまでに(バクテリオ)クロロフィル類のメチル基転移酵素の構造学的知見は皆無であり、そのメチル化反応の分子機構は不明です。本研究では構造に基づいた BchU の SAM 依存的 メチル化機構の解明を目的とし、この酵素の X 線結晶構造解析を行った。
解析結果から、 BchU はホモダイマーを形成しており、N 末端ドメインがそのダイマー形成に関与していることがわかりました。また、C 末端ドメインは典型的なメチル基転移酵素のクラス I モチーフを保持していました。さらに SAM との複合体の構造も決定し、BchU との結合様式を明らかにすることができました。これらの解析結果と変異導入実験に基づき、(バクテリオ) クロロフィル類における SAM 依存的メチル化機構を明らかにしました。現在、さらに詳細な基質認識機構を明らかにするために、構造をベースとした変異実験を進めています。
ビタミンB12の基本テトラピロール骨格形成を担うCbiLの反応メカニズムの解明
[FEBS Journal, 274, 563-573 (2007)]
ビタミンB12は、複雑な構造をもつ低分子化合物で、この生合成には 15種類以上の酵素が関与しています。ビタミンB12の基本骨格は、コバルトを中心金属としてもつコリン骨格を持ち、これはテトラピロール環 から炭素(C20位)が一つ抜け落ちた"歪んだ形"をしています。このテトラピロール環からの炭素の脱離反応は、脱離するC20位炭素がCbiLと呼ばれる酵素によってメチル化を受けることによりスタートします。 本研究では、ビタミンB12生合成経路のなかで、C20位のメチル化機構を解明することを目的としています。
CbiLとメチル基供与体アナログ(S-アデノシルホモシステイン:SAH)との複合体構造を決定し、これまで不明であった触媒残基を推定することができました。 さらに、基質であるテトラピロール化合物の結合様式をコンピューターシュミレーションにより予想したところ、基質結合が結合する際にはドメイン間の大きな構造変化が伴うことが 予想されました。現在、これら構造からの推定を実証することを進めています。
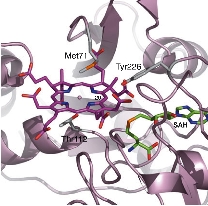
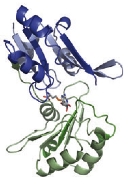
CbiLモノマーは、二つのドメインから構成されており、ドメイン間の間隙に基質は結合することがわかりました。 このドメインの動き(TLSモーション)を計算すると、二つのドメインは"カニのハサミ"のように基質を抱え込むことが予想されました。
--------------------------以下、作成中です------------------------
紅藻やラン藻などの光合成生物では、光合成装置や光捕集装置にテトラピロール色素が存在し、これらが機能してはじめて効率的な光合成が可能になります。 これらの色素合成代謝は、実は未だに未解明な部分が多く残されています。私は、色素合成・分解に関わる幾つか鍵酵素に焦点を合わせ、その機能・反応メカニズムに迫るべく研究を進めてきました。
バクテリオクロロフィルc; 生合成に関与するメチル基転移酵素のメチル化機構
[J. Mol. Biol., 360, 839-849 (2006)]
緑色硫黄光合成細菌は膜外アンテナ系としてクロロゾームを持つ。Chlorobium tepidumはクロロゾーム内の色素として バクテリオクロロフィルcを持ち、 近年行われたゲノム解析と分子遺伝学的手法からその生合成経路が明らかになりつつあります。この経路で BchU は、S-adenosylmethionine (SAM) をメチル基供与体として 20 位をメチル化する酵素(メチル基転移酵素) として同定されました。これまでに(バクテリオ)クロロフィル類のメチル基転移酵素の構造学的知見は皆無であり、そのメチル化反応の分子機構は不明です。本研究では構造に基づいた BchU の SAM 依存的 メチル化機構の解明を目的とし、この酵素の X 線結晶構造解析を行った。
解析結果から、 BchU はホモダイマーを形成しており、N 末端ドメインがそのダイマー形成に関与していることがわかりました。また、C 末端ドメインは典型的なメチル基転移酵素のクラス I モチーフを保持していました。さらに SAM との複合体の構造も決定し、BchU との結合様式を明らかにすることができました。これらの解析結果と変異導入実験に基づき、(バクテリオ) クロロフィル類における SAM 依存的メチル化機構を明らかにしました。現在、さらに詳細な基質認識機構を明らかにするために、構造をベースとした変異実験を進めています。



ビタミンB12の基本テトラピロール骨格形成を担うCbiLの反応メカニズムの解明
[FEBS Journal, 274, 563-573 (2007)]
ビタミンB12は、複雑な構造をもつ低分子化合物で、この生合成には 15種類以上の酵素が関与しています。ビタミンB12の基本骨格は、コバルトを中心金属としてもつコリン骨格を持ち、これはテトラピロール環 から炭素(C20位)が一つ抜け落ちた"歪んだ形"をしています。このテトラピロール環からの炭素の脱離反応は、脱離するC20位炭素がCbiLと呼ばれる酵素によってメチル化を受けることによりスタートします。 本研究では、ビタミンB12生合成経路のなかで、C20位のメチル化機構を解明することを目的としています。
CbiLとメチル基供与体アナログ(S-アデノシルホモシステイン:SAH)との複合体構造を決定し、これまで不明であった触媒残基を推定することができました。 さらに、基質であるテトラピロール化合物の結合様式をコンピューターシュミレーションにより予想したところ、基質結合が結合する際にはドメイン間の大きな構造変化が伴うことが 予想されました。現在、これら構造からの推定を実証することを進めています。


CbiLモノマーは、二つのドメインから構成されており、ドメイン間の間隙に基質は結合することがわかりました。 このドメインの動き(TLSモーション)を計算すると、二つのドメインは"カニのハサミ"のように基質を抱え込むことが予想されました。
--------------------------以下、作成中です------------------------