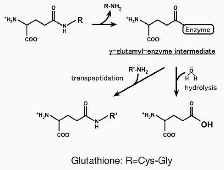
| 生体にとって必須の抗酸化物質であるグルタチオン(GSH;
γ-Glu-Cys-Gly)は、グルタミン酸側鎖を介した特殊なペプチド結合(γ-グルタミル結合)を有し、
一般的なプロテアーゼによる分解を受けません。γ-グルタミルトランスペプチダーゼ (GGT)
は、GSHのγ-グルタミル結合を切断できる唯一の酵素であり、 GSH
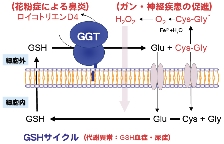
代謝と生体異物解毒の初期反応を担う鍵酵素として抗酸化ストレスに決定的な役割を果たし、動脈硬化症や腎障害、パーキンソン病、ガン細胞の多剤耐性など広
範囲の疾患に深く関与しています。GGTは、いわゆる
Ntn-ヒドロラーゼファミリーに属し、不活性な前駆体は自己触媒的プロセッシングにより活性型ヘテロダイマーに成熟します。 本研究では、GGT
の成熟過程から反応機構までを構造学的に追跡し、GGTの分子機構に迫っています。 |
|
|
|
 |
|
 |
|
|
GGTの反応機構の解明
[Proc. Natl. Acad. Sci. USA., 103, 6471-6476 (2006)] |
|
|
|
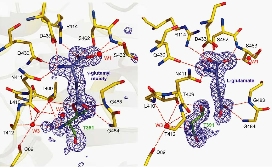
1960年代に発見された酵素でしたが、長年の間、その反応機構は謎に包まれていました。大腸菌由来の成熟型
GGTの構造の決定に成功し、さらにフラッシュクーリングにより、アシル-酵素中間体(活性残基である小サブユニットのN末Thr391にg-グルタミル
基が結合)をトラップし、中間体構造も明らかにしました。この構造やGGT-グルタミン酸の構造から、基質認識、反応の分子機構、変異解析の構造基盤を与
えました。
|
|
|
 |
 |
|
|
GGTの自己触媒的な成熟化機構の解明
[J. Biol. Chem., 288, 2433-2439 (2007)] |
|
|
|
グルタチオン代謝の鍵酵素であるGGTは、一つのオープンリーディングフレームか
ら合成され、翻訳後プロセシングにより二つのサブユニットに分かれヘテロダイマーとなり、成熟型酵素になります。
この反応は自己触媒的に起こり、Thr-391がこの活性残基であり、酵素反応の活性残基でもあることが生化学実験からわかっていました。そこで、前駆体
をミミックしたT391A変異体の構造を決定し、GGTの自己触媒的なプロセスの過程を明らかにしました。
成熟型酵素との構造比較から、前駆体GGTはプロセシングを経ることによってはじめて基質結合ポケットを形成し、特異的な基質の認識が可能になるように構
造変化することがわかりました。
|
|
|
|
 |
|
|
|
|
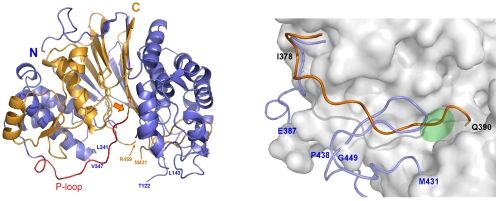
成熟化に伴うGGTの構造変化
オレンジは前駆体GGT、ブルーは成熟型GGTの構造です。プロセシングによる構造変化によって、グリーンで示した活性部位が形成されます。 |
|
前駆体GGTの結晶構造
オレンジ矢印は、自己触媒的なプロセシングの切断部位を示しています。 |
|
GGT阻害剤の反応様式
[J. Mol. Biol., 380, 361-372 (2008)] |
|
|
 |
|
|
ヒトの血中GGT活性(γ-GTP値)は肝癌やアルコール性肝疾患などの肝胆道疾患で顕著に増大することか
ら、医療診断の指標として広く利用されています。
また最近では、GGT活性とパーキンソン病、心臓血管病、神経変性などの発症との関連性も報告されており、医学的観点からも本酵素の活性をコントロールす
ることが注目されてきています。
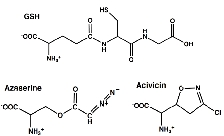
本研究では、大腸菌GGTと二つの基質アナログ型阻害剤(アザセリンおよびアシビシン)との複合体構造をそ
れぞれ決定し、
これまで不明瞭であった阻害剤の結合部位およびその結合様式の詳細を明らかにしました。両阻害剤は、GGTの触媒残基(Thr391)と共有結合を形成し
て基質ポケットに結合していました。
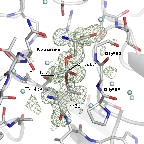
興味深いことに、GGT-アザセリン複合体では、Thr391から攻撃を受けた炭素原子が四面体配置をとっており、反応の遷移状態が安定化されて止まって
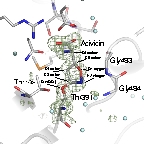
いました。 同様に、五員環構造を持つアシビシンとThr391も四面体配置(sp3混成軌道で結合)をとっており、これからアシ
ビシンの共有結合化反応には五員環の開閉を伴う全く
新しい反応機構が考えられました。この阻害メカニズムは、アミノ酸配列や反応の類似性を総合すると、大腸菌GGTのみならず細菌から哺乳類で機能するグル
タミン(酸)を基質とする酵素群 (GGTおよびGatファミリー)に共通することが示唆されました。
|
|
|
 |
|
|
|
 |
|
|
 |
|
 |
|
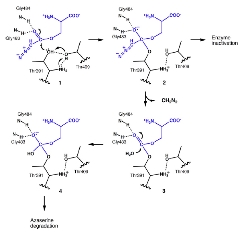
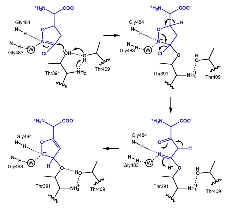
アシビシンの反応機構
アシビシンは単なる求核置換反応ではなく、環構造の開閉を伴う反応によりGGTに共有結合する。 |
|
|
GGT阻害剤アザセリンの反応機構 |
|
|
基質ポケットにフタをするループ構造の機能
[FEBS J., 277, 100-1009 (2010)] |
|
|
|
|
 |
|
|
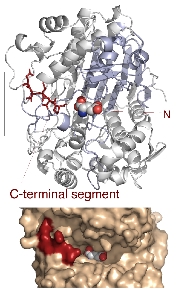
GGTの触媒ポケットには基質に由来するγ-グルタミル基を覆っているループ(lid-loop)があり、触
媒ポケットが空の時はディスオーダーし、基質が存在する時はポケット
を覆うように固定されることを明らかになってきた。Lid-loop上のアミノ酸への変異導入は酵素活性を大幅に減少させることから、このループはGGT
の酵素反応に必須であり、
基質のリクルートに関与していると考えていました。驚いたことに、lid-loop配列を持たないGGTを持つ生物種が幾つか存在し、このようなGGTで
はどのように基質を認識している のかを明らかにするために、まず枯草菌GGTの結晶構造解析を試みました。
枯草菌GGT基質アナログ複合体の構造には触媒ポケットを覆うようなループはなく、結合した基質アナログはそ
の大部分が溶媒に露出していました。
この構造が得られたことにより、これまでの酵素反応におけるlid-loopの役割についての概念は覆されました。今後、変異導入やin
vivo試験によって詳細を検討する予定です。
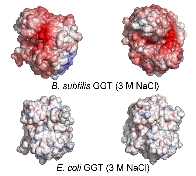
また、枯草菌GGTは3M
NaCl存在下でも活性を保持できる耐塩性の酵素であり、醸造産業への応用も期待されています(共同研究者が応用研究を展開中)。
分子表面の電荷計算から、大腸菌GGTでは電荷を保持できない高塩濃度条件下においても、
枯草菌GGTは強く負に帯電しており、これが耐塩性の一因であると考えられました。
|
|
 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

