|
日本の蛋白質化学者の草分けである赤堀四郎先生(元阪大総長・蛋白研初代
所長)は、 「深海熱水孔周辺の黄鉄鉱(FeS2)表面で起こる化学反応(代謝)
が発端となり生命は誕生した」という表面代謝説を唱え、現在も根強く支持されています。
その真偽は定かではありませんが、鉄と硫黄の組み合わせは高い反応性を生みだし、 現在の生物はこれらの原子種を巧みに利用していることは事実です。 |
|
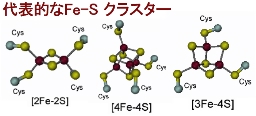
生物界にはFe-Sクラスターと呼ばれるコファク
ターを持つ蛋白質が呼吸や光合成といった普遍的な代謝を担っています。これらFe-Sクラスターは単純な構造ですが、 細胞内では多成分で構成される
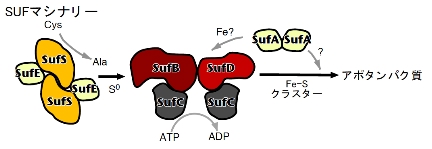
複雑なマシナリーがこれを担っています。 その代表あるSUF
マシナリーは、オペロンにコードされる六種の酵素/タンパク質(SufABCDSE)から 構成されています。
|
|
|
|
|
 |
|
|
一般的な酸化還元状態 |
|
|
[2Fe-2S]
[酸化型]2Fe3+
[還元型]Fe3++Fe2+ |
[4Fe-4S]
[酸化型]2Fe3++2Fe2+
[還元型]Fe3++3Fe2+
|
|
|
 |
|
|
|
|
|
私が研究をスタートした時点(2003年)では、これらのタンパク質群の具体的な
役割は明らかではありませんでしたが、 近年、各成分の生化学研究が急速に進みました。 SufS/SufE複合体はcysteine
desulfurase(硫黄原子の供与体)として機能し、SufA二量体は鉄原子の供与体と予想しています。
SufB/SufC/SufDの具体的な役割は不明ですが、Fe‐S
クラスター形成反応における中心的な機能は疑いがありません。興味深いことに、SufBCDは複合体を形成し、
その中でSufCはATPaseとして機能します。このSufCはABC-ATPase (ABC
トランスポーターのATPaseドメイン、構造変化の動力源)と類似性を示す(約26%) ことから、SufBCD
複合体の分子機能にはダイナミックな構造変換が含まれると考えています。本研究では、この SUF
マシナリーにおいて、それぞれの多成分複合体がどのように Fe-S クラスターを合成し、 どのような機構でアポタンパク質に Fe-S
クラスターを供与する のかという反応およびその調節メカニズムを解明することを目的としています。
|
|
|
SufCモノマーは新規な活性調節機構をもつ不活性型ATPase |
|
|
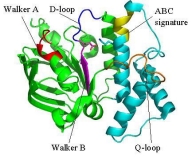
SufCの一次構造は膜輸送タンパク質であるABC
トランスポーターのATPaseドメイン(ABC-ATPase)に類似性(20-30%)を示します。
ABC-ATPaseの機能モチーフとして知られるWalker A, Walker B, ABC
signatureといった配列がSufCにおいても高度に保存されており, 実際にSufCは弱いながらもATPase活性を持ちます。
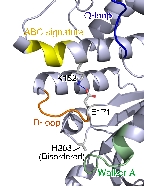
本研究では大腸菌由来のSufCの結晶構造を2.5Å分解能で決定しました。SufCの全体構造はABC-ATPaseのそれと類似していましたが、
ATP加水分解に関与する保存されたアミノ酸残基(Glu171)の側鎖がヌクレオチド結合ポケットの反対側に向き、別のドメインの側鎖と塩橋を形成して
いました。このような構造は、これまでのATPaseでは報告例がないことから、SufCには独自の活性調節機構が備わっていることがわかりました。
(SufC2-SufD2複合体構造・機能解析も参照して下さい) |
|
|
|
 |
|
 |
|
|
| 新規フォールディングモチーフをもつSufD構造とその機能解析 |
|
|
|
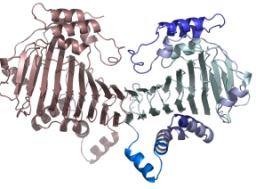
SufDのアミノ酸配列は、他のタンパク質とは相同性がないため、その機能は全くわかりませんでした。そこ
で、機能の手掛かりを得るために、SufDのダイマー構造を決定しました。SufD構造は、β-へリックスと呼ばれる特殊なフォールディングをおり、構造
モチーフデータベースでは新規スーパーファミリー分類される新規構造タンパク質でした。立体構造からも機能の推定が困難であったため、この特殊な構造を念
頭におき、遺伝学的な手法により機能に関わる残基を調べることにしました。
|
|
|
 |
|
|
|
 |
|
|
|
|
SufDダイマーの結晶構造: 新規 β-ヘリックス構造を持つ。 |
|
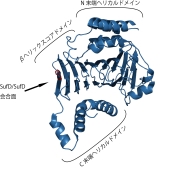
SufDドメイン構造:逆平行のβシートでダイマーが形成されている。 |
|
|
|
 |
|
|
|
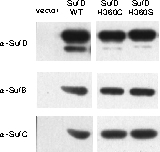
SufD の構造と機能の相関を調べるために,様々な部位のアミノ酸残基に変異を導入し、これら変異
SufD の in vivo 機能を
大腸菌変異株の相補能から評価ました。この実験系では温度感受性プラスミドの入れ換えを利用しており、SufDが機能しなければ43℃で生育することがで
きません。その結果,
1) N 末端 αヘリカルドメインの欠失は SufD の機能にほとんど影響しない。
2) C 末端のα-ヘリカルドメインを削除すると重篤な影響が現れ, α7-9 を欠失すると相補能が完全に失われた.
3) 二量体会合面のH360をヒスチジン以外の19種類のアミノ酸に置換すると機能不全となった.
H360変異体では、タンパク質の安定性や複合体形成能は変化しないことも実験的に証明でき、Fe-Sクラスターの合成への直接的な関与が強く示唆されま
した。
ヒスチジンはFe-Sクラスターの配位子となりえるため、H360が合成途中のクラスターの結合部位であることが期待されます。興味深いことに,
H360 の側鎖は、二量体会合面の分子内部(βヘリックスの内側)に完全に埋もれています。
|
|
| In vivo相補実験:SufD
H360に変異を導入すると大腸菌は生育できなくなる。 |
|
|
 |
|
|
| SufC2-SufD2複
合体の構造とATPase SufCの構造変化 |
|
|
|
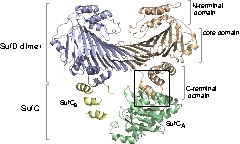
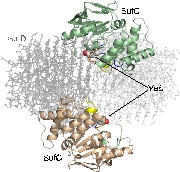
SufC2-SufD2複合体構造を決定したところ、SufC
はATP加水分解に適した構造をとっていました。上述のとおり、SufCはモノマー状態では不活性であったことから、複合体形成によって活性化されること
がわかりました。
また、SufDダイマーに結合した二つのSufCは、複合体中では離れて位置していました。ABC-トランス
ポーターのアナロジーで考えると、二分子のSufCはダイマーを形成することが推定されます。
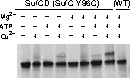
そこで、SufCの予想ダイマー会合面にシステイン変異を導入し、ジスルフィド結合可能な距離まで近づくかどうかを調べました。その結果、複合体中の
SufCは、ATP+Mg依存的にダイマーを形成することを明らかにしました。
|
|
|
 |
|
|
|
 |
|
|
 |
|
|
|
| 分子内架橋により、SufC2-SufD2複
合体中のSufCがダイマーを形成することを実証できた。SufCダイマーの形成により複合体の大きな構造変化が予想されます。 |
|
ダイナミックな構造変化を伴うSUFマシナリーの作動モデル
|
|
|
|
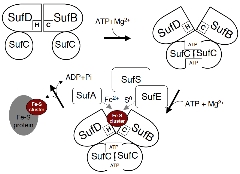
| 現在までの成果から、SUFマシナリーにおけるFe
-Sクラスター合成機構の一端が見えてきました。SUFマシナリーの作動機構は、生物界最大の膜輸送体スーパーファミリー(ABC-
transporter)の原型であり、共通した原理で全く異なる機能(クラスター合成と膜間輸送)を成し遂げるという驚きの可能性を示し、その作動モデ
ルを提唱しています。現在、このモデルの実証を目指し、研究を進めています。 |
|
|
|
|
|
 |
|
|
| ATP結合による複合体の構造変化により、分子内部に埋もれたリガンド
(幾つかは同定済み)が露出し、Fe-Sクラスターを合成することが浮かび上がってきました。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

