研究内容
<概略>
-
当教室は、生体防御機構と免疫学的恒常維持機構を明らかにすることを目的として、健常および炎症疾患病態における免疫細胞の機能とこれを制御する分子作用機序について研究を行っています。特に、樹状細胞を研究対象として、微生物感染やがんに対する生体防御機構とともに自己免疫疾患やアレルギー、移植片拒絶反応などの免疫疾患の発症・増悪機構の解明に取り組んでいます。さらに、これらの成果に基づいて、微生物感染やがんに対する新規ワクチン、免疫疾患に対する疾患特異的治療法の開発へ繋がる応用研究を推進しております。
<研究テーマ>
-
1. 樹状細胞による炎症慢性化機構の解明と制御
2. 樹状細胞による微生物感染防御機構とがんに対する監視機構の解明と制御
3. 制御性樹状細胞を用いた免疫疾患に対する新規免疫細胞療法の開発
<樹状細胞とは?>
-
樹状細胞 (dendritic cells; DCs)(図1)は樹状突起を有する系統マーカー陰性、主要組織適合遺伝子複合体(major histocompatibility complex; MHC)クラスII陽性のプロフェッショナル抗原提示細胞であり、造血幹細胞よりミエロイド系やリンパ球系分化経路を経て未熟樹状細胞へ分化し、さらに微生物感染などの様々な刺激によりMHC分子と共刺激分子の発現が増強した成熟樹状細胞に至ります。生体において樹状細胞は分化系列、成熟段階の異なる多様なサブセットとして末梢非リンパ組織やリンパ組織に広く存在しており、機能的には通常型樹状細胞(conventional DCs; cDCs)と形質細胞様樹状細胞(plasmacytoid DCs; pDCs)に大別されます。
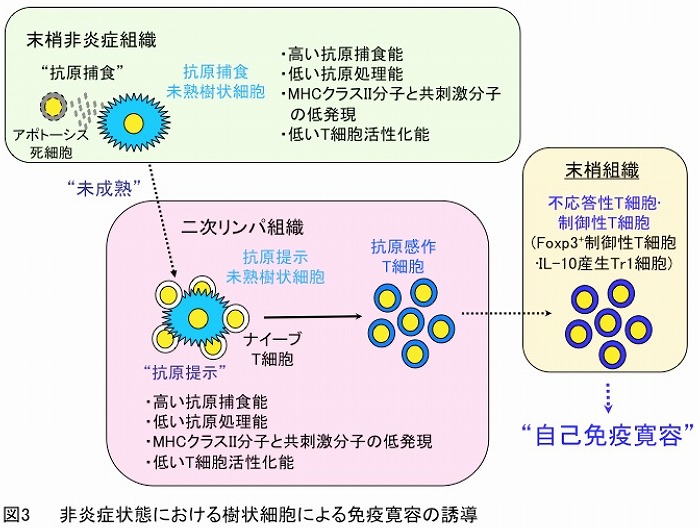
成熟樹状細胞はナイーブT細胞のT細胞レセプター (TCR)/CD3複合体にMHC分子/抗原ペプチド複合体を提示する(抗原刺激)とともにCD80/CD86-CD28等の共刺激分子間の結合による刺激(共刺激)を与え、環境要因により様々なタイプの抗原特異的エフェクターT細胞を分化誘導して一次免疫応答を惹起します(図2)。一方、定常状態(非炎症状態)において、未熟樹状細胞は抗原不応答性(アナジー)T細胞や様々な制御性T細胞の誘導・増幅を介して末梢性免疫寛容を誘導すると考えられております(図3)。また、未熟樹状細胞の機能改変により調整された免疫寛容誘導性樹状細胞(tolerogenic DCs)が抗原不応答性T細胞や制御性T細胞のさらなる誘導・増幅能を示し、免疫応答を抑制することも知られております。
このように樹状細胞は炎症状態では自然免疫と適応免疫を繋ぐ最も強力な抗原提示細胞として免疫系を賦活し、定常状態では免疫寛容を誘導する制御細胞として免疫学的恒常性の維持に重要であると考えられております。また、樹状細胞サブセットの特徴的な機能は様々な内的要因や異なる外的刺激などの環境要因によって修飾・影響を受けて、免疫応答を多彩に調節しています。さらに、臨床研究からも免疫疾患の発症・増悪への樹状細胞サブセットの関与が明らかになりつつあります。 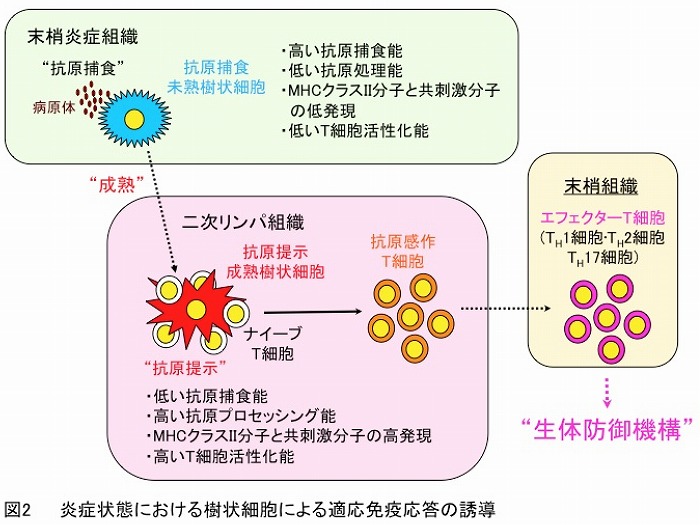
研究紹介
1.制御性樹状細胞による免疫応答制御機構の研究
-
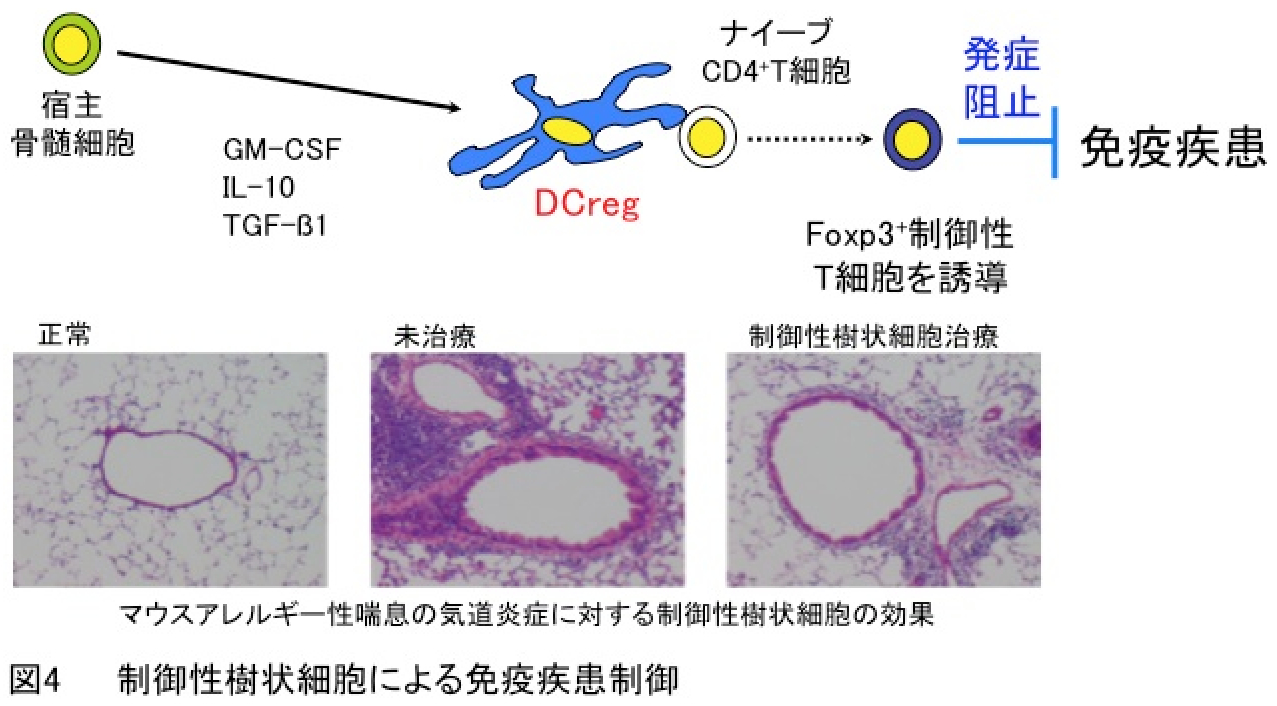
ヒトとマウスの新しい樹状細胞サブセットとして制御性樹状細胞(regulatory DCs; DCreg)を発見し、従来の免疫反応を正に誘導するDC機能とは異なる免疫反応を抑制する“DCreg”という全く新しい概念を提唱しました(Immunity・2003; Blood・2003)。これは、樹状細胞機能が免疫反応の惹起にのみ重要であるという当時の概念を覆す、世界で最初の発見であります。さらに、様々なマウス免疫疾患モデルにおいて制御性樹状細胞を用いた免疫細胞療法がIL-10産生能や制御性T細胞生成能に基づいて治療効果を示すことを明らかにしました(図4)(Blood・2006; Blood・2007; J. Allergy Clin. Immunol.・2008; Blood・2009)。
-
これまでの研究成果から制御性樹状細胞について特許が成立しており(特許第4547174;特許第4919453号)、今後はヒト制御性樹状細胞を用いた免疫細胞療法の免疫疾患への臨床応用に向け、ヒト制御性樹状細胞の安全性を含めた大量調整法の確立、治療プロトコールの作成等を行いたいと考えております。
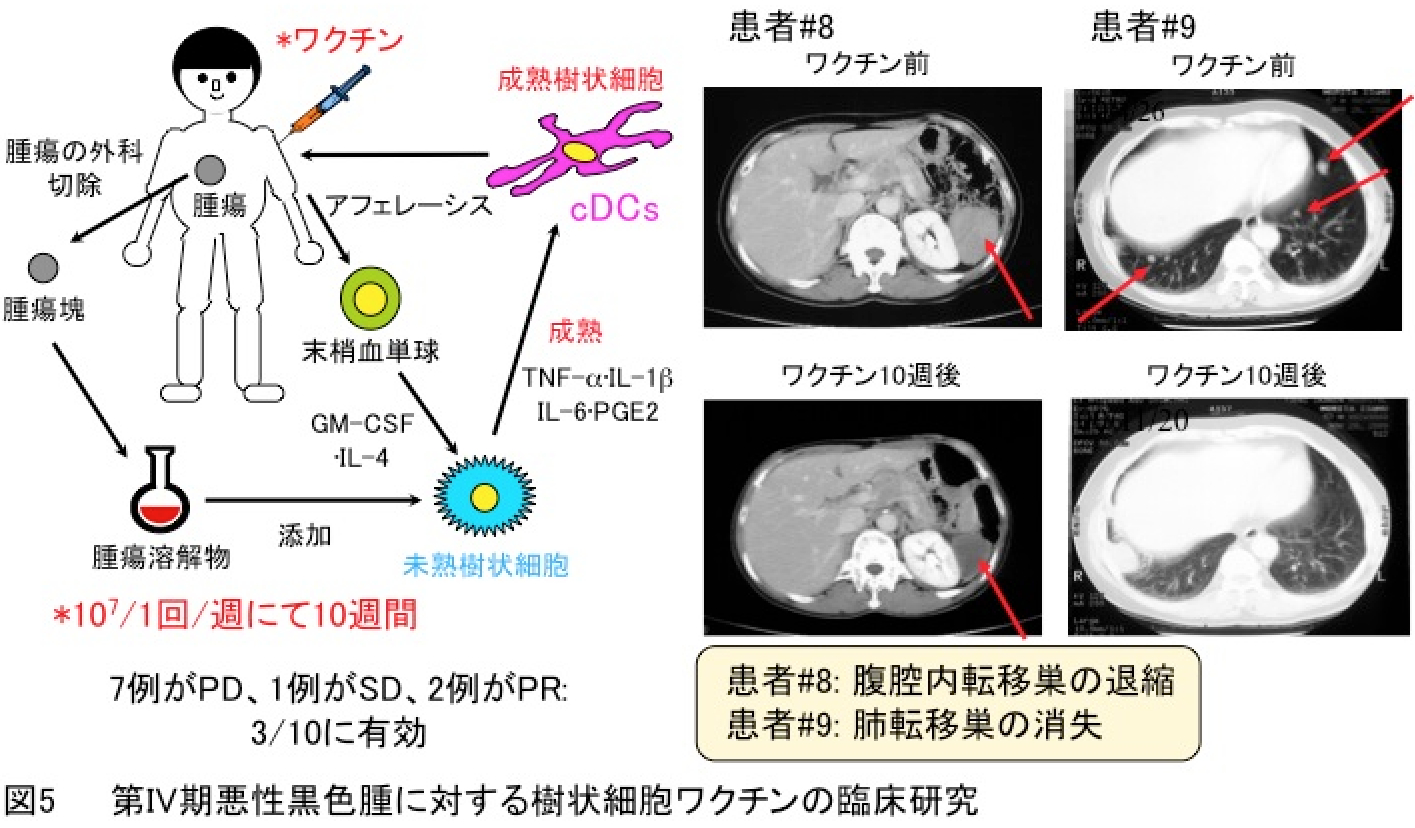
2.第IV期悪性黒色種に対する樹状細胞ワクチン療法の臨床研究
-
ヒト樹状細胞に関する研究成果に基づいたトランスレーショナルリサーチとして、東京大学医科学研究所附属病院において、本邦初の第IV期悪性黒色種に対するDCsワクチン療法の臨床試験を行いました(Melanoma Res.・2003; Clin. Cancer Res.・2005)。その結果として、7例がPD、1例がSD、2例がPRであり3/10に有効とされました(図5)。
現在はこの技術をバイオベンチャー企業への技術移転し、樹状細胞ワクチン療法が事業化されています。
3. 形質細胞様樹状細胞によるウイルス感染での炎症反応とT細胞免疫応答の制御
-
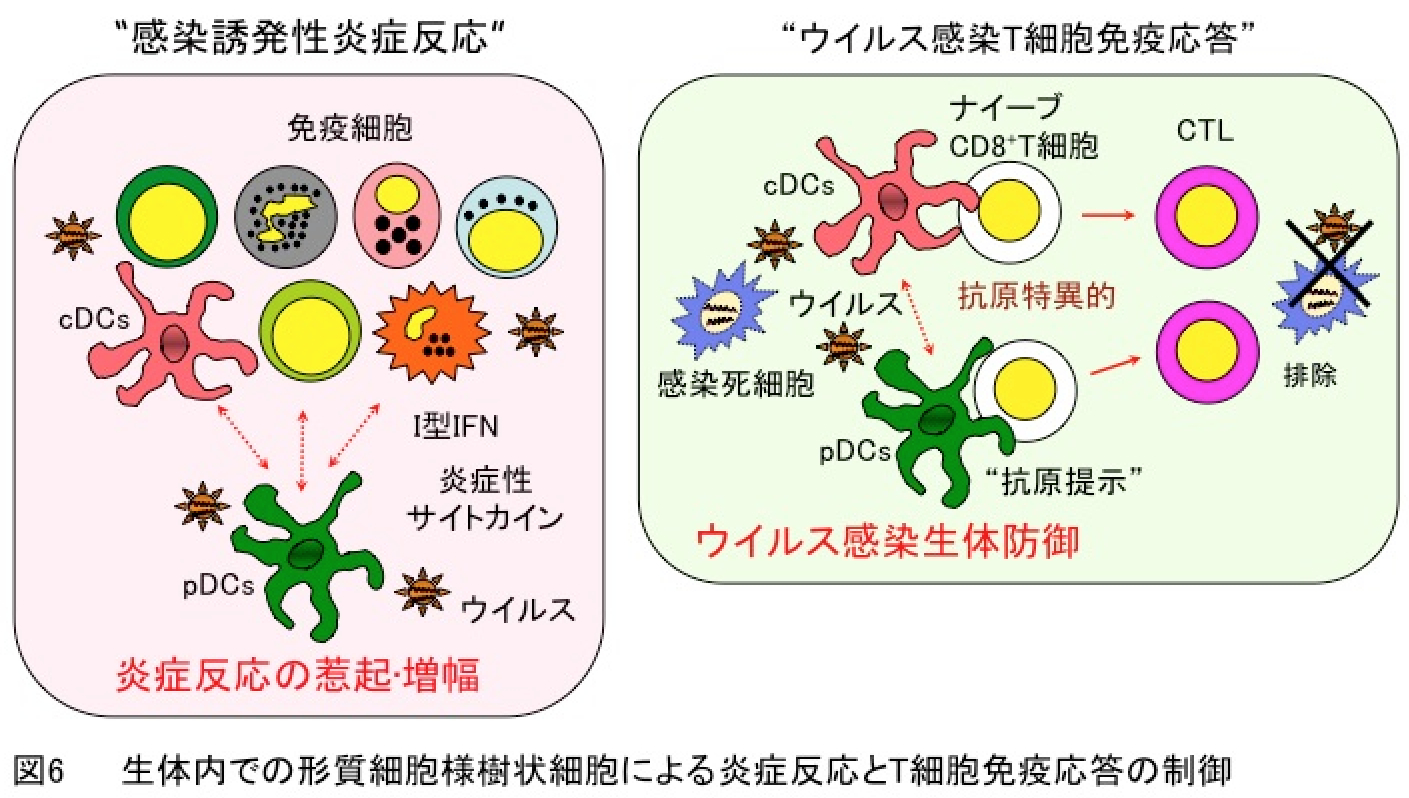
形質細胞様樹状細胞は通常型樹状細胞とは異なり核酸を認識するToll様受容体 (Toll-like receptor; TLR)7とTLR9のみを高発現し、多量のI型IFN (interferon)を産生する高度に専門化した抗原提示細胞です。従って、形質細胞様樹状細胞はこの特性により病原体感染防御に重要であることが推察されております。また、臨床所見から形質細胞様樹状細胞は自己免疫疾患やアレルギー疾患の炎症組織へ選択的に集積していることから、炎症反応の惹起と増幅に関与しているとされております。しかしながら、生体内での形質細胞様樹状細胞の機能解析はその特異的発現機能分子が未同定であることやこの細胞の特異的欠失法の欠如により妨げられ、免疫応答における形質細胞様樹状細胞の役割は不明でありました。
-
そこで生体内での炎症反応とT細胞免疫応答における形質細胞様樹状細胞の役割およびその特異的発現機能分子として同定しました“Siglec-H”による制御を、Siglec-H欠損マウスと形質細胞様樹状細胞特異的欠失マウスを用いて検討しました。その結果、形質細胞様樹状細胞がウイルス感染による炎症反応の惹起に関与するのみならずI型IFN産生と細胞傷害性T細胞生成を介した宿主からのウイルス排除に必須であることを世界で初めて明らかにし(図6)、Siglec-HがpDCsの機能を阻害することも見出しました(Immunity・2011)。この研究成果は樹状細胞研究での重要な位置づけとして評価されております(Previews in Immunity・35:851-853, 2011)。
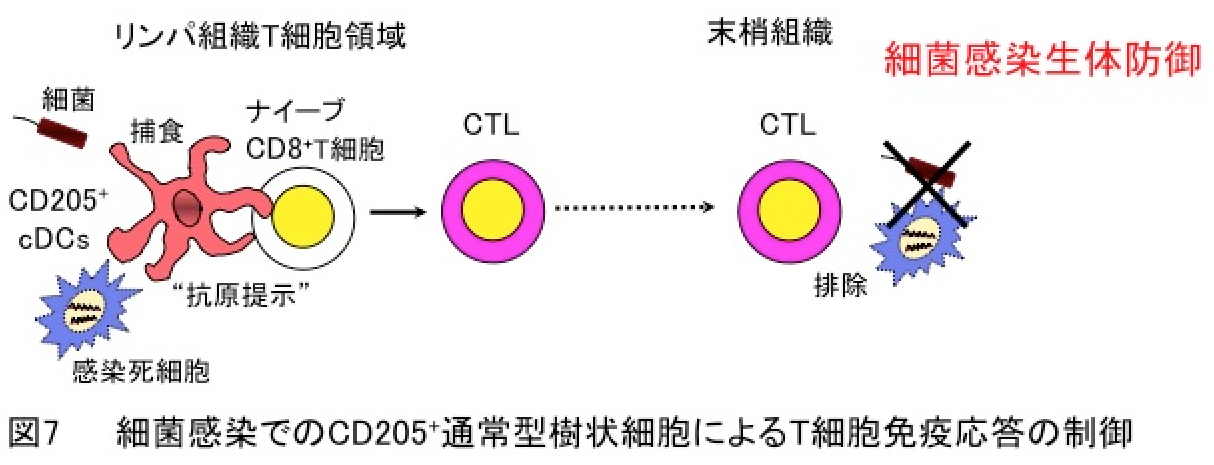
4. CD205陽性通常型樹状細胞による細菌感染に対する生体防御機構
-
CD205陽性通常型樹状細胞はリンパ組織のT細胞領域に存在し、IL-12の高産生細胞として知られております。さらに、CD205陽性通常型樹状細胞は細菌やがん細胞の高い捕食能と抗原提示能に基づいて細胞傷害性T細胞を高誘導することから、その細菌やがんに対する生体防御への関与が示唆されておりました。しかしながら、CD205陽性通常型樹状細胞の生体内機能解析は特異的消失法の欠如により妨げられ、免疫応答におけるその役割は明らかではありませんでした。
-
CD205陽性通常型樹状細胞特異的欠失マウスを作製して解析した結果、CD205陽性通常型樹状細胞が細菌捕食による抗原提示と細胞傷害性T細胞の活性化に基づいた細菌感染に対する宿主防御反応において重要な役割を担うことを証明しました(図7)(Proc. Natl. Acad. Sci. USA・2012)。
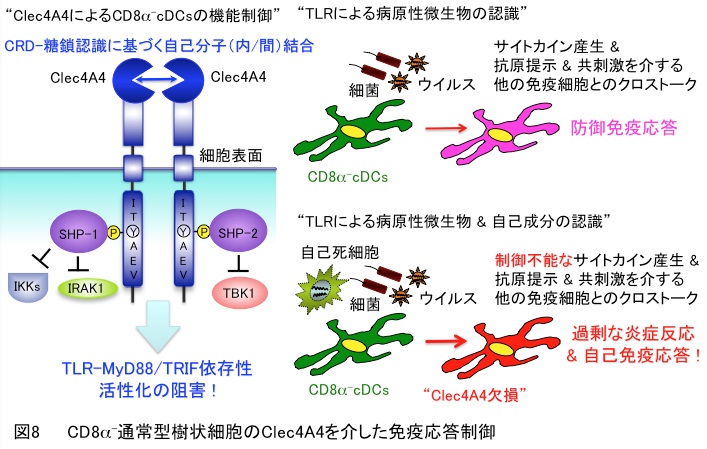
5. CD8α¯通常型樹状細胞のClec4A4を介した免疫応答制御
-
これまで樹状細胞の活性化について盛んに研究が行われてきましたが、樹状細胞の活性化がどのように調節され、炎症反応や自己免疫疾患を抑制するかについては不明でした。Clec4A4はCD8α¯通常型樹状細胞に特異的に発現するCタイプレクチンレセプターであり、その細胞外領域に糖鎖認識ドメイン(CRD)、細胞内領域に免疫受容体抑制性チロシンモチーフ(ITIM様配列)を有することが知られています。CD8α¯通常型樹状細胞のClec4A4を介する機能制御機構とその免疫応答における役割を解明するために、Clec4A4発現レトロウイルスベクターとClec4A4欠損マウスを用いた解析を行いました。
-
その結果、CD8α¯通常型樹状細胞においてClec4A4はそのCRDと修飾糖鎖との会合を介して自己分子(内/間)結合することにより、ITIM依存性抑制性シグナル経路が恒常的に惹起し、TLR依存性活性化を抑制することが明らかとなりました。さらに、Clec4A4はCD8α¯通常型樹状細胞の活性化リミッター分子として、炎症反応・抗原特異的T細胞応答・免疫病態を負に調節することが明らかとなりました(図8)(Nat. Commun.・2016)。
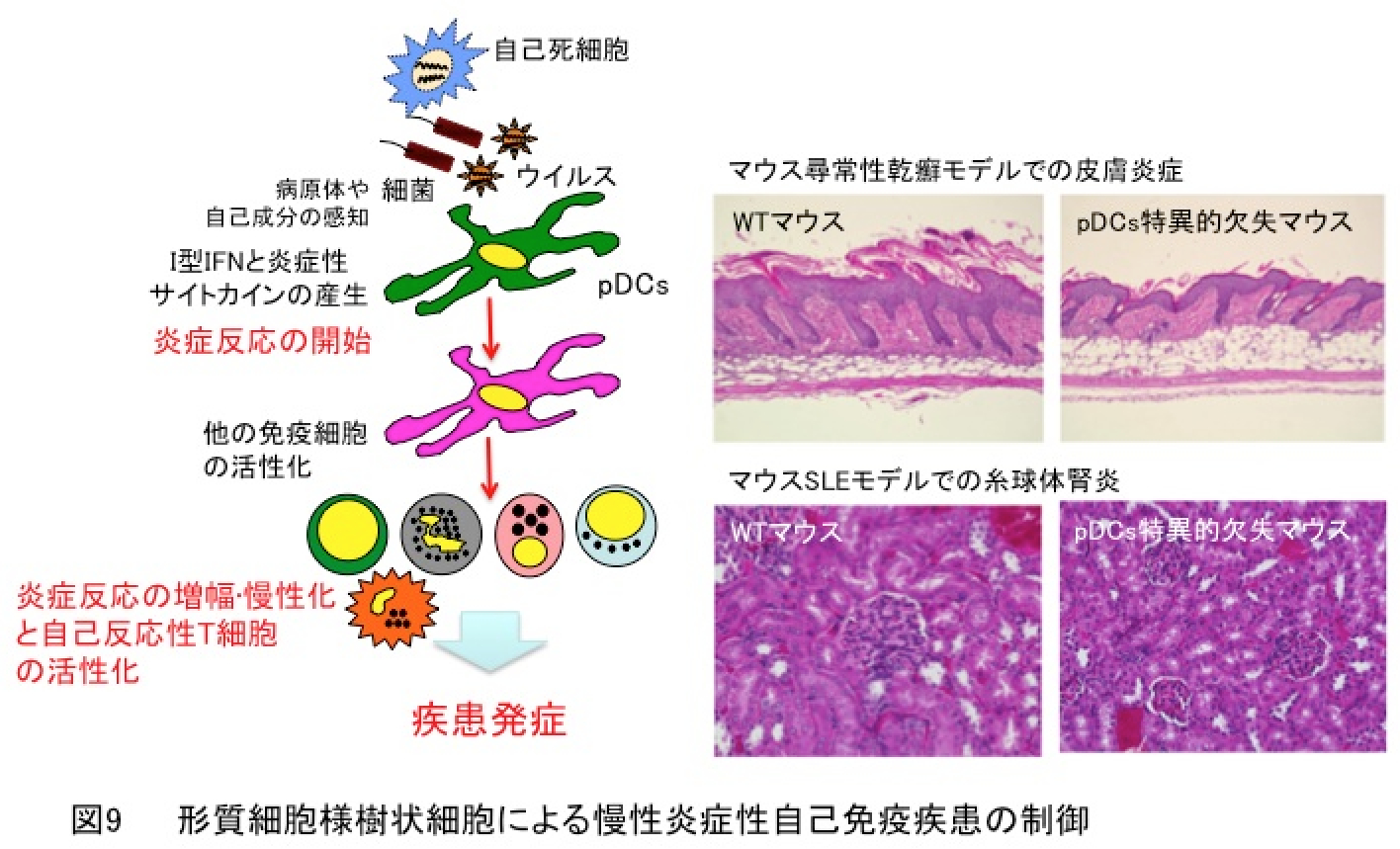
6. 形質細胞様樹状細胞による慢性炎症性自己免疫疾患の制御
-
尋常性乾癬や全身性エリテマトーデス(SLE)などの慢性炎症性自己免疫疾患ではI型IFNの産生が血中で顕著に認められ、炎症組織に形質細胞様樹状細胞が選択的に集積していることが知られております。しかしながら、これらI型IFN介在性慢性自己免疫疾患の病態形成における形質細胞様樹状細胞の役割については不明でした。形質細胞様樹状細胞特異的欠失マウス(Immunity・2011)を用いて解析した結果、形質細胞様樹状細胞が自己死細胞由来の自己成分と病原体(細菌やウイルスなど)の認識後、過度のサイトカインを産生することにより炎症反応を開始し、さらに他の免疫細胞を活性化して炎症の増幅と慢性化を導くことが明らかになりました。さらに、形質細胞様樹状細胞が通常型樹状細胞と協調的に自己成分を自己反応性T細胞に抗原提示することにより自己免疫応答を惹起し、I型IFN介在性慢性自己免疫疾患の発症を導くことも解明されました(図9)(Sci. Rep.・2016)。
-
本研究は平成23年度科学技術振興機構(JST)戦略的創造研究推進事業(さきがけ)「炎症の慢性化機構の解明と制御」領域の採択課題「自己免疫疾患における形質細胞様樹状細胞の役割と制御機構の解明」の研究成果です。
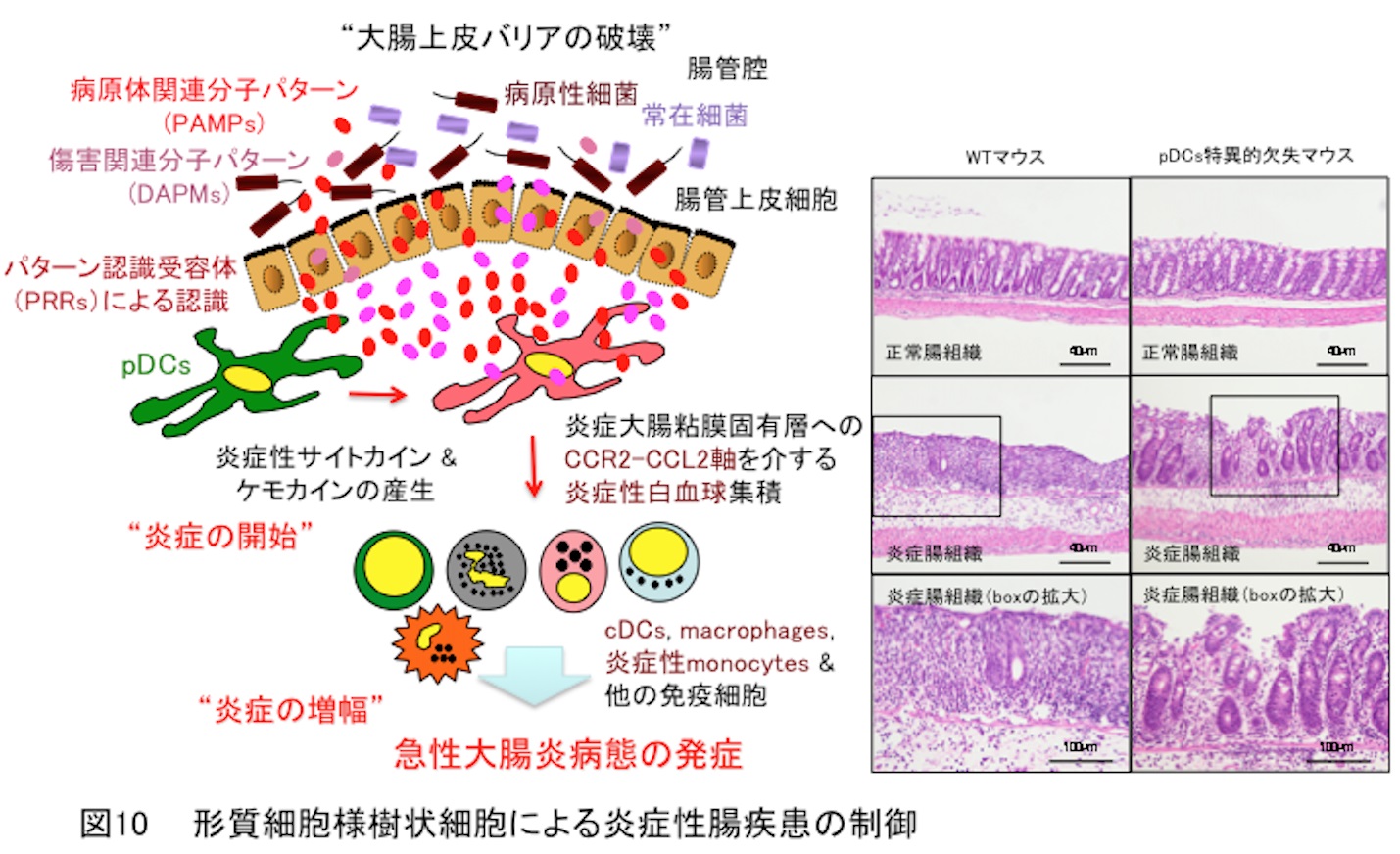
7. 形質細胞様樹状細胞による炎症性腸疾患疾患の制御
-
炎症性腸疾患は消化管に原因不明の炎症を呈し、長期間の腹痛・下痢・血便・下血・発熱・体重減少等の症状を示す慢性疾患です。炎症性腸疾患には潰瘍性大腸炎やクローン病などが含まれ、根治的治療法は確立されておらず、厚生労働省の特定疾患に指定されております。また、炎症性腸疾患は近年、我が国でも罹患率の増加が顕著であり、食生活の変化や高齢化社会の加速により将来的にさらに罹患率が上昇することが危惧されております。このことから炎症性腸疾患の発症・増悪機構の解明が急務であり、根治治療法の確立が切望されております。
-
炎症性腸疾患では、消化管に存在する免疫細胞が異常に活性化して過剰な炎症を引き起こしておりますが、最初にどの免疫細胞が消化管炎症を惹起して、炎症性腸疾患を導くのか不明でした。形質細胞様樹状細胞特異的欠失マウス(Immunity・2011)を用いて解析した結果、消化管内リンパ組織において形質細胞様樹状細胞はサイトカインとケモカインを産生することにより炎症を開始するとともに、白血球の消化管浸潤を促進して消化管炎症病態の形成に寄与し、炎症性腸疾患疾患の発症と増悪を導くことが解明されました(図10)(Mucosal Immunol.・2017)。
8. 形質細胞様樹状細胞による経口免疫寛容の誘導
-
食物中には、生体にとって異物である異種タンパク質が含まれ、飲食により食物に対するアレルギー(食物アレルギー)を引き起こすことがあります。食物の種類や生体の免疫システムの状況によってアレルギーの症状は異なりますが、一般的には下痢、湿疹、じんま疹、咳、ぜんそくを発症します。重篤な場合はアナフィラキシーショックを発症し、命にかかわることがあります。卵、ピーナッツ、そばなどがよく知られていますが、こうした食物アレルギーの予防は社会的な課題の1つで、食品衛生法の施行規則により、特定原材料の表示が義務化されるまでに至っています。
-
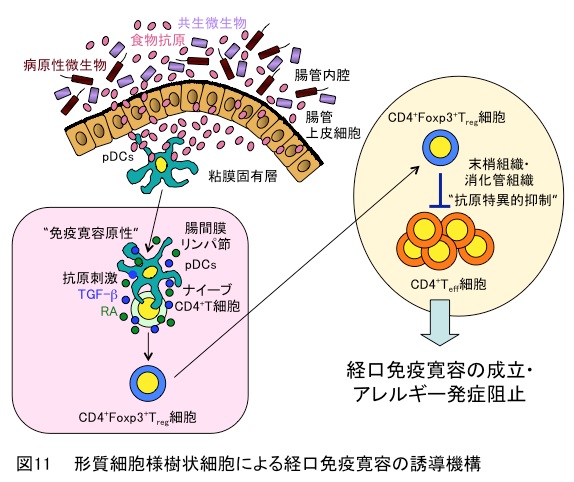
消化管では、これらの免疫反応を抑制する経口免疫寛容が成立しており、通常、すべての食物に対するアレルギーは起こりません。しかし、食物アレルギーは、経口免疫寛容が適切に働かないことが原因で引き起こされます。経口免疫寛容の成立には、腸間膜リンパ節において、T細胞の食物に対する過剰な反応を抑えることが重要であると考えられていました。しかし、その詳細な成立機構は明らかとなっていませんでした。形質細胞様樹状細胞特異的欠失マウス(Immunity・2011)を用いて解析した結果、食物抗原を捕食した形質細胞様樹状細胞が腸間膜リンパ節においてTGF-βとレチノイン酸の自己産生制御機構に基づく制御性T細胞の誘導を介して、食物抗原反応性T細胞をすることにより経口免疫寛容の成立を導くことが解明されました(図11)(J. Allergy Clin. Immunol.・2018)。
9. IL-22結合タンパクによる乾癬の制御
-
乾癬は、皮膚に炎症がおこって紅斑(血管拡張や充血が真皮内に起こり赤くなった状態)ができ、次第にその表面が銀白色の細かいかさぶた(鱗屑)で覆われ、やがてそれがはがれ落ちる落屑(らくせつ)が主な症状の激しいかゆみを伴う皮膚慢性免疫病です。乾癬は白色人種の2-4%、日本人の0.1%(10万人以上)が罹患していると推定されております。乾癬の原因は不明でありますが、遺伝的素因があり、これに様々な環境因子が加わると免疫異常が起こり、発症すると考えられております。
-
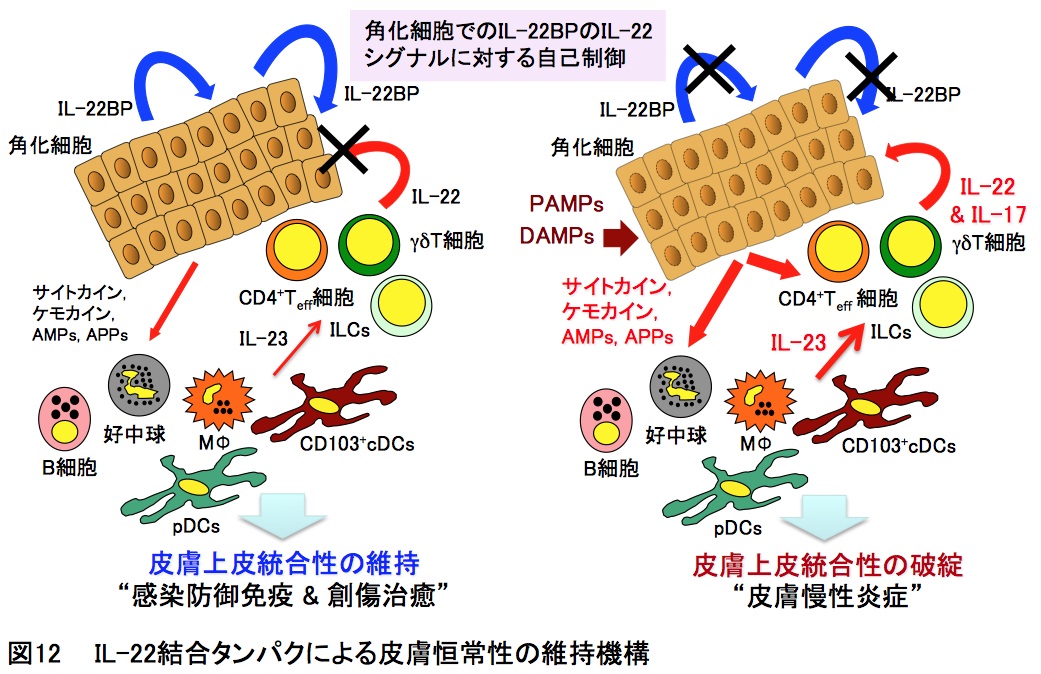
乾癬の治療は重症度に応じて、外用薬(ステロイド剤やビタミンD誘導体)療法、内服薬(ビタミンA誘導体や免疫抑制剤)療法、紫外線療法を用いた対処療法が中心でありますが、根治治療法には至っておりません。乾癬の皮膚では表皮細胞である角化細胞の異常な増殖や分化が起き、白血球が集積して炎症反応が起こっておりますが、この皮膚の病態を制御する仕組みは不明でした。角化細胞の産生するIL-22結合タンパクに着目し、その欠損マウスを用いて解析した結果、IL-22結合タンパクは乾癬の発症に関与するIL-22を介する角化細胞の異常機能を是正し、乾癬症状を緩和することが解明されました(図12)(Front. Immunol.・2018)。
10. 舌下免疫療法によるアレルギー疾患防御機構
-
花粉症、喘息、食物アレルギー、アトピー性皮膚炎などのアレルギー疾患は、体の中に入った無害な異物(アレルゲン)に対する過剰な免疫応答(アレルギー反応)により生じると考えられております。アレルギー疾患はわが国を含む先進国において、約半世紀前から患者数が急増し、今や国民の約30%が罹患している国民病とも言える状態にあります。アレルギー疾患の治療では薬物を用いた対症療法が中心でありますが、根本的な治療法に至っておりません。舌下免疫療法は、スギ花粉症とダニアレルギー性鼻炎に対して、近年、保険適用されたアレルギー反応の低下を目指した免疫療法(減感作療法)であり、安全性の高い根治的治療法としての可能性が注目されております。
-
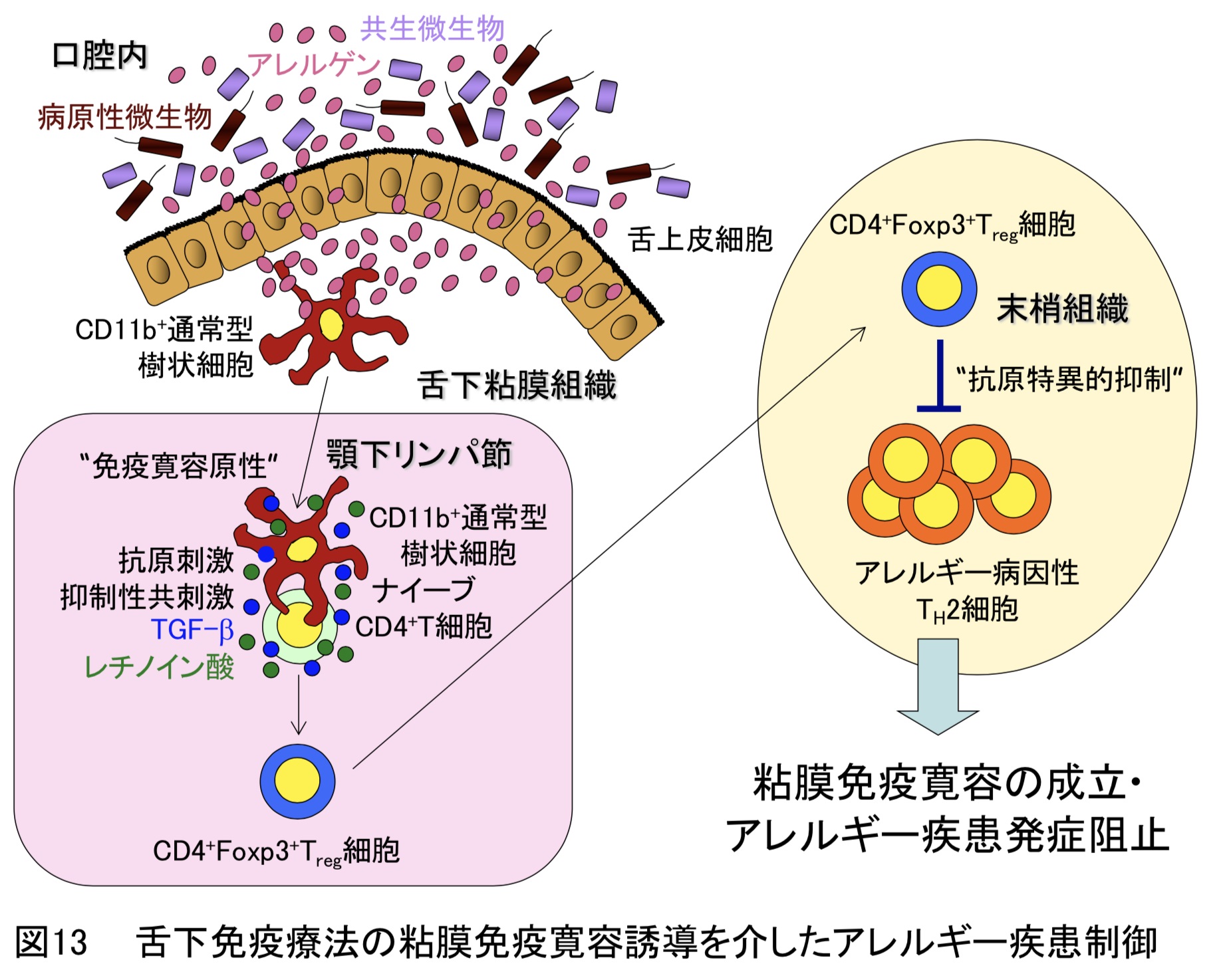
しかしながら、舌下免疫療法の適用疾患は上述のアレルギー疾患に限定されており、他のアレルギー疾患に対する有用性については検証されておらず、また、そのアレルギー反応を抑制する仕組みも不明のままでした。本研究では、マウスアレルギー実験モデルを用いて、舌下免疫療法がアレルギー性喘息、食物アレルギー、全身性アナフィラキシーに対して防御効果を示すことを明らかにしました。さらに、舌下免疫療法のアレルギー疾患防御機構には、顎下リンパ節において通常型樹状細胞が制御性T細胞の誘導を介して免疫寛容を成立させることが重要であることを解明しました(図13)(Commun. Biol.・2020)。
11. 樹状細胞によるアトピー性皮膚炎の制御
-
アトピー性皮膚炎は強いかゆみを伴う湿疹が全身または部分的に発生する皮膚のアレルギー疾患で、よくなったり悪くなったりを繰り返すという特徴があります。アトピー性皮膚炎の原因は、これまでに完全には明らかにされていませんが、遺伝的・体質的な要因や環境要因、生活動作などの様々な要因が複雑に関わることで発症すると考えられています。アトピー性皮膚炎はわが国を含む先進国において、過去30年で患者数が急増し、先進国の小児の最大20%と成人の1〜3%が罹患しております。アトピー性皮膚炎の治療方法は、主に適切なスキンケアと塗り薬(ステロイド、アトピー性皮膚炎治療薬など)による薬物治療ですが、根本的な治療法に至っておりません。
-
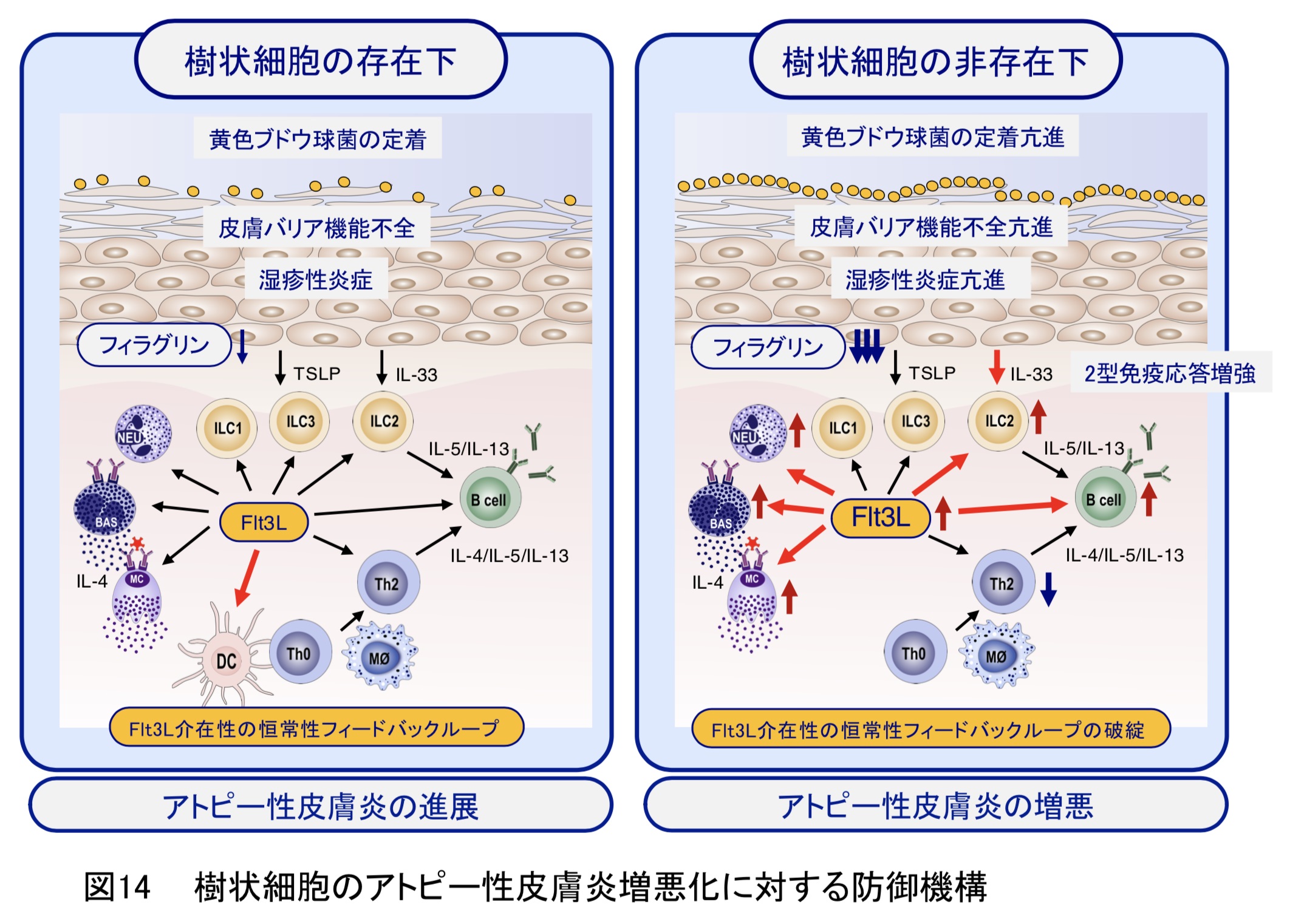
アトピー性皮膚炎は、皮膚のバリア機能の低下などを背景として、皮膚から入った無害な異物(アレルゲン)に対する過剰な免疫応答(アレルギー反応)により生じると考えられております。細菌やウイルスなどの病原性微生物に対する免疫応答はこれらを捕食した樹状細胞により開始されると想定されております。一方、アトピー性皮膚炎などのアレルギー疾患における樹状細胞の役割については不明な点が多く残されております。本研究では、樹状細胞の欠損状態におけるマウスアトピー性皮膚炎モデルを初めて検証することにより、樹状細胞はアトピー性皮膚炎の発症や増悪化には必要では無く、むしろ免疫バランスを維持することによりアトピー性皮膚炎の増悪化阻止に作用する重要な知見を得ることができました(図14)(Front. Immunol.・2021)。
12. 消化管細菌叢異常による樹状細胞の機能不全に基づく経口免疫寛容の破綻機構
-
免疫機構は、白血球である免疫細胞が体内に侵入した細菌やウイルス等の病原体を異物(抗原)として認識後に排除し、宿主を病原体の感染から守る高度なシステムです。一方、環境物質や自己成分に対して不適切な免疫反応が起こった場合には、アレルギーや自己免疫病の発症に繋がると考えられています。このため、生体には免疫寛容とよばれる不利益な免疫反応を阻止する機構が備わっております。消化管では、宿主と常在細菌との共生(Symbiosis)が消化管免疫機能に影響を与えていると考えられています。また、消化管では摂取した食物に対する免疫反応を阻止する経口免疫寛容が成立しており、通常、食物に対する免疫反応は起こりません。しかしながら、経口免疫寛容が破綻すると食物に対する免疫反応が起こり、アレルギーが発症すると考えられております。本邦ではアレルギーの罹患率は増加傾向にあり、厚生労働省の実態調査結果では、国民の約2人に1人が何らかのアレルギーに罹患し、アレルギー発症の低年齢化が指摘されております。また、本邦の幼児を対象としたコホート研究では、2歳までの抗生剤の使用と5歳におけるアレルギー疾患の有症率との間には有意な関連があり、抗生剤を使用した群でアレルギー疾患の発症リスクが高くなっていることが報告されております。
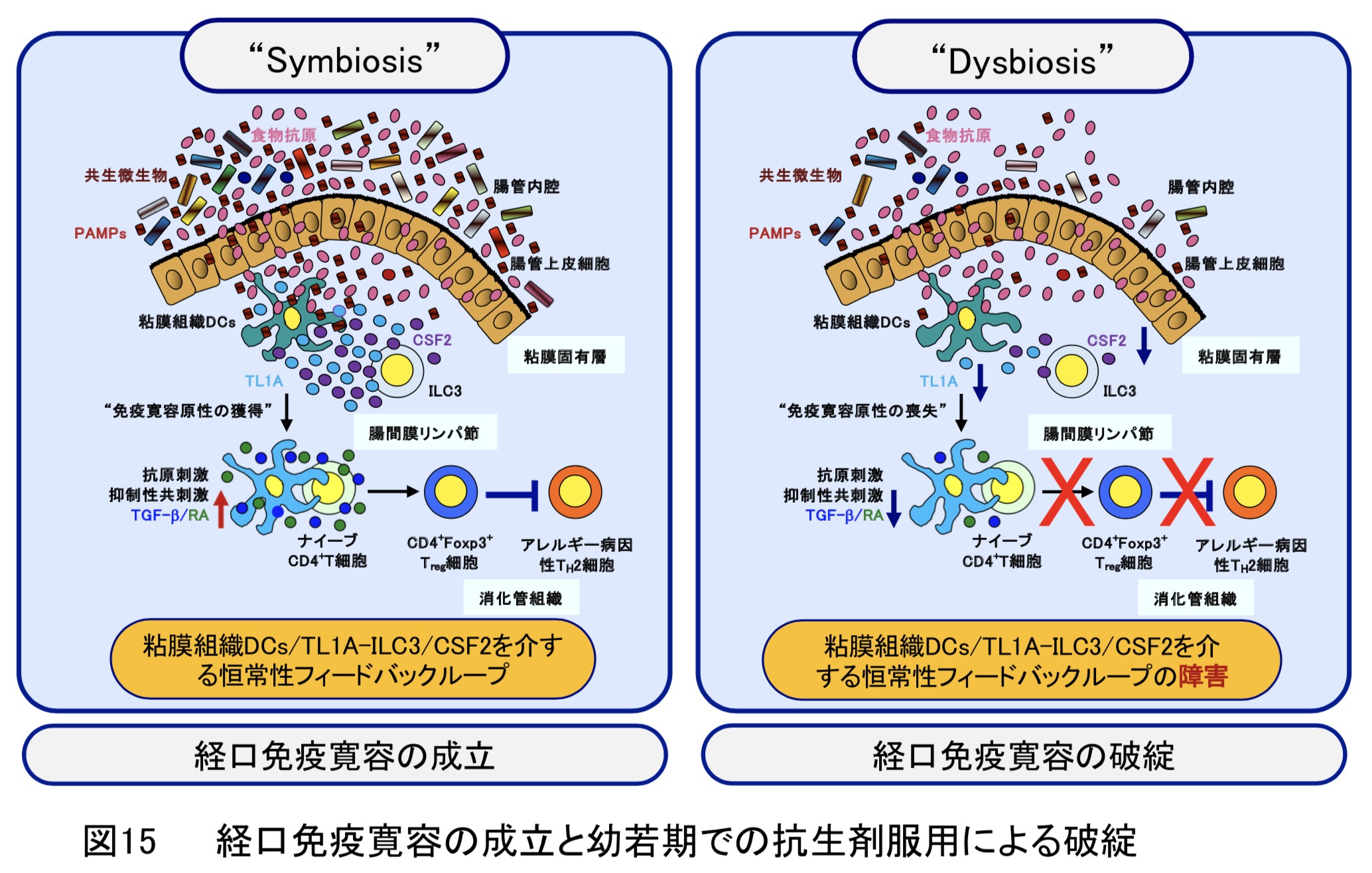
-
現在までに、抗生剤の服用により消化管細菌叢異常(Dysbiosis)が誘発されることが知られておりますが、そのアレルギー発症リスクの増加に繋がる経口免疫寛容の破綻への関与や作用機序は不明でした。本研究では、粘膜組織に存在する樹状細胞(粘膜組織樹状細胞)を欠損した遺伝子改変マウス(粘膜組織樹状細胞消失マウス)を用いて、アレルギー発症を阻止する経口免疫寛容の成立には粘膜組織樹状細胞が必須であることを明らかにしました。また、抗生剤を服用した幼若期の野生型マウスは消化管細菌叢異常を呈し、経口免疫寛容の成立障害や粘膜組織樹状細胞の免疫抑制機能の低下を示すことを見出しました。このことから、幼若期の抗生剤服用による消化管細菌叢異常が粘膜組織樹状細胞の免疫抑制機能を喪失させることにより経口免疫寛容の破綻を導くことを解明しました(図15)(Cell Rep.・2023)。
13. 樹状細胞発現免疫チェックポイント分子によるがん免疫応答の制御
-
ヒト(宿主)では、体外から侵入した細菌やウィルス等の異物を排除する免疫機構が備わっており、体内で発生したがん細胞の排除にも重要な働きをしています。しかしながら、がん細胞は免疫機構から逃れるために様々な手段を用いております。免疫チェックポイントは、自己の細胞や組織への不適切な免疫応答や過剰な炎症反応を阻止する免疫抑制機構です。代表的な免疫チェックポイント分子として、T細胞に発現するCTLA-4やPD-1などの抑制性受容体があり、これらの抑制性受容体に生理的なリガンドが結合すると、T細胞の増殖や機能が抑制されます。がん細胞はこの免疫抑制機構を利用して宿主の免疫機構から回避していることが明らかとなっております。現在、免疫チェックポイント阻害剤の臨床応用により一部のがん種で画期的な治療効果が認められておりますが、その治療耐性獲得とともに依然多くのがん種では治療抵抗性を示すことが問題となっております。
-
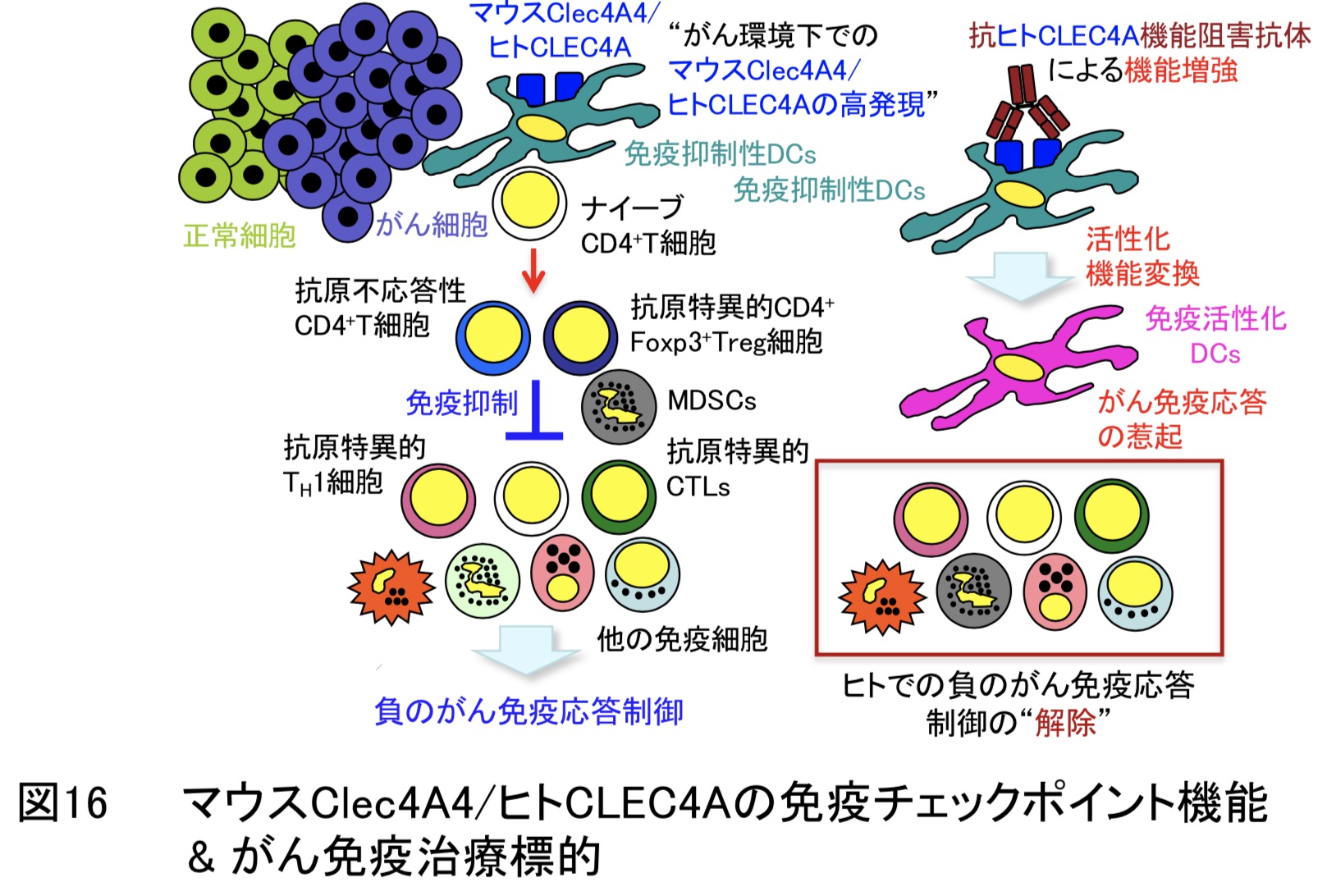
また、免疫チェックポイント阻害剤の使用では自己に対する免疫応答の活性化により生じる重篤な副作用も危惧されております。このため、これらの課題を克服するために、新たな免疫チェックポイント分子の同定とその阻害剤の開発が世界中で行われております。本研究では、樹状細胞にのみ発現する抑制性受容体であるマウスClec4A4(Nat. Commun.・2016、図8参照)とヒト相同分子のヒトCLEC4Aが免疫チェックポイント分子として、がん免疫応答を制御することを解明しました。さらに、抗ヒトCLEC4A機能阻害抗体は免疫チェックポイント阻害剤として高いがん治療効果を示すことを明らにしました。この成果を応用することで、がんに対する新たな免疫治療法の開発につながる可能性が期待できます。(図16)(Cancer Immunol.Res.・2023)。
Copyright ©
2026
2013 - 2026
University of miyazaki All Rights Reserved.