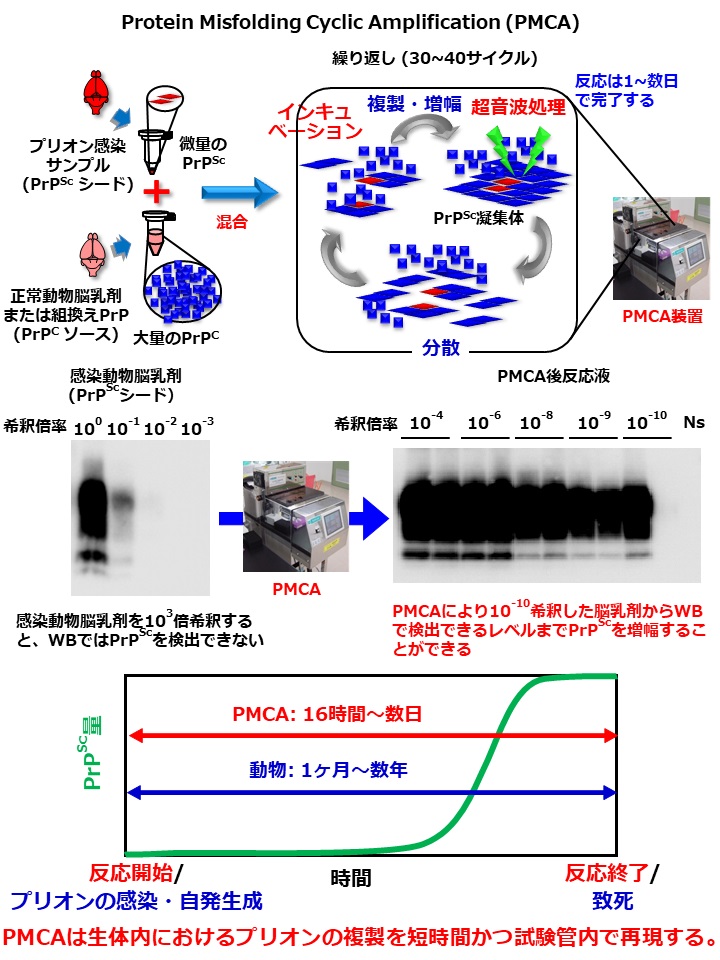
プリオン病(別名:伝達性海綿状脳症)は進行性かつ致死性の伝達性神経変性疾患で、その病原体プリオン(Proteinous infectious particleから語呂のよいPrionと命名された)は、病原体特異的な遺伝子を持たず、主に単一のタンパク質“プリオンタンパク(PrP)”により構成されていると推測されています。我々は、プリオン病の病態分子機構の理解を前進させることに貢献した、試験管内PrP異常化反応系であるPMCA法(Protein misfolding cyclic amplification)やRT-QUIC法(Real-time quaking-induced conversion)の開発・発展に携わってきました。プリオン病の病態・伝達性・発生機序の理解について、これまでの研究によりPrPの構造変化と凝集化がそれらを引き起こす根本的な要因であることが判明しましたが、その一方、正常型から異常型への構造変換プロセスや孤発性プリオン病や遺伝性プリオン病における異常型PrPの自発的生成機構、さらには遺伝子を持たない病原体の“株strain”現象をもたらす分子機序などの重要な研究課題が解明されずに残されています。我々は上記の試験管内PrP異常化反応系に加え、プリオン感染培養細胞、プリオン病動物モデルを通じた一連の実験によりそれらの課題を解明すべく研究を重ねています。
<代表論文>
Imamura M, Tabeta N, Kato N, Matsuura Y, Iwamaru Y, Yokoyama T, Murayama Y. Heparan Sulfate and Heparin Promote Faithful Prion Replication in Vitro by Binding to Normal and Abnormal Prion Proteins in Protein Misfolding Cyclic Amplification. J Biol Chem. 2016;291(51):26478-26486.
Sano K, Atarashi R, Ishibashi D, Nakagaki T, Satoh K, Nishida N. Conformational properties of prion strains can be transmitted to recombinant prion protein fibrils in real-time quaking-induced conversion. J Virol. 2014;88(20):11791-801.
Imamura M, Kato N, Yoshioka M, Okada H, Iwamaru Y, Shimizu Y, Mohri S, Yokoyama T, Murayama Y. Glycosylphosphatidylinositol anchor-dependent stimulation pathway required for generation of baculovirus-derived recombinant scrapie prion protein. J Virol. 2011;85(6) :2582-8.
Atarashi R, Moore RA, Sim VL, Hughson AG, Dorward DW, Onwubiko HA, Priola SA, Caughey B. Ultrasensitive detection of scrapie prion protein using seeded conversion of recombinant prion protein. Nat Methods. 2007;4(8):645-50.
Atarashi R, Sim VL, Nishida N, Caughey B, Katamine S. Prion strain-dependent differences in conversion of mutant prion proteins in cell culture. J Virol. 2006;80(16):7854-62.
☆神経変性疾患の診断・予防・治療法の開発
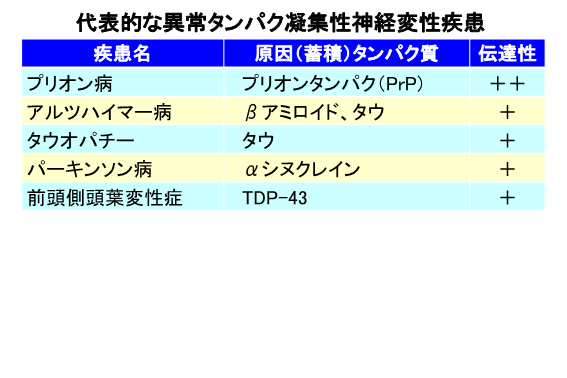
パーキンソン病、アルツハイマー型認知症などの神経変性疾患は、加齢とともに罹患率が上昇し、日本を筆頭に老齢化の進む先進国において克服すべき、重要な医学的社会的な課題です。そのためには病態分子機構の解明を進めるとともに、有効な診断・予防・治療法の開発が必要であり、その研究も国内外で活発に行われていますが、現時点ではいまだ発展途上段階です。近年、それらタンパク質異常凝集性神経変性疾患がプリオン病と類似の機構による体内伝播、さらには人工的な実験条件下では、別個体にも伝達されうる実験的証拠が集積され、その分子機構の共通性が注目を集めています。すなわち、原因タンパク質が、何らかの要因によりβシード構造に富んだ異常凝集体(アミロイドフィブリル~オリゴマー)を神経系のある部位で自然生成し、それらが、正常構造の単量体の原因タンパク質を巻き込んで同様な異常構造の多量体を増幅し、体内に拡がっていくというドミノ反応に例えられる現象です。実際、プリオン病の原因タンパク質であるプリオンタンパク(PrP)以外にも、αシヌクレイン、βアミロイド(Aβ)、タウタンパク(Tau)、TDP-43等の異常凝集体がプリオン様伝播を示すことを試験管内、培養細胞、動物への接種実験等により報告されています。
αシヌクレインの異常凝集が原因で起こる疾患としてはパーキンソン病(PD)、レビー小体型認知症(DLB)、多系統委縮症(MSA)があり、合わせてαシヌクレノパチーとも呼ばれます。一方、アルツハイマー型認知症(ATD)はAβとTauの両者の異常凝集(それぞれ老人斑と神経原線維変化)が見られることが知られています。その他、Tau単独の異常凝集は、ピック病、大脳皮質基底核変性症(CBD)、進行性核上性麻痺(PSP)、嗜銀顆粒性認知症(AGD)等を引き起こし、それらの疾患を総称してタウオパチーと呼ばれています。TDP-43による疾患としては筋委縮性側索硬化症(ALS)や前頭側頭葉変性症(FTLD-TDP)が挙げられます。我々はプリオン病で得た知見を生かした新たな視点・発想を基にこれらの疾患群の神経変性メカニズムの解明、さらに診断・予防・治療法へと発展・応用するべく研究を行っています。
<代表論文(診断法関連)>
Sano K, Atarashi R, Satoh K, Ishibashi D, Nakagaki T, Iwasaki Y, Yoshida M, Murayama S, Mishima K, Nishida N. Prion-Like Seeding of Misfolded α-Synuclein in the Brains of Dementia with Lewy Body Patients in RT-QUIC. Mol Neurobiol. 2018;55(5):3916-3930.
Takatsuki H, Fuse T, Nakagaki T, Mori T, Mihara B, Takao M, Iwasaki Y, Yoshida M, Murayama S, Atarashi R, Nishida N, Satoh K. Prion-Seeding Activity Is widely Distributed in Tissues of Sporadic Creutzfeldt-Jakob Disease Patients. EBioMedicine. 2016;12:150-155.
Mori T, Atarashi R, Furukawa K, Takatsuki H, Satoh K, Sano K, Nakagaki T, Ishibashi D, Ichimiya K, Hamada M, Nakayama T, Nishida N. A direct assessment of human prion adhered to steel wire using real-time quaking-induced conversion. Sci Rep. 2016;6:24993.
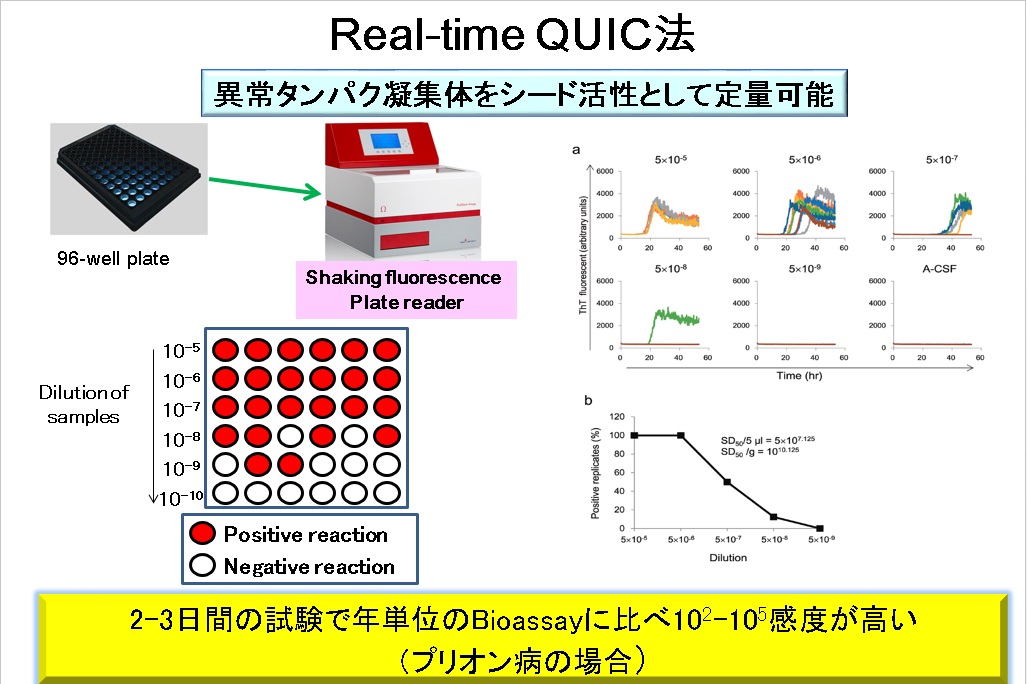
Atarashi R, Satoh K, Sano K, Fuse T, Yamaguchi N, Ishibashi D, Matsubara T, Nakagaki T, Yamanaka H, Shirabe S, Yamada M, Mizusawa H, Kitamoto T, Klug G, McGlade A, Collins SJ, Nishida N. Ultrasensitive human prion detection in cerebrospinal fluid by real-time quaking-induced conversion. Nat Med. 2011;17(2):175-8.
<代表論文(予防・治療法関連)>
Miyazaki Y, Ishikawa T, Kamatari YO, Nakagaki T, Takatsuki H, Ishibashi D, Kuwata K, Nishida N, Atarashi R. Identification of Alprenolol Hydrochloride as an Anti-prion Compound Using Surface Plasmon Resonance Imaging. Mol Neurobiol. 2019;56(1):367-377.
Nakagaki T, Satoh K, Ishibashi D, Fuse T, Sano K, Kamatari YO, Kuwata K, Shigematsu K, Iwamaru Y, Takenouchi T, Kitani H, Nishida N, Atarashi R. FK506 reduces abnormal prion protein through the activation of autolysosomal degradation and prolongs survival in prion-infected mice. Autophagy. 2013;9(9):1386-94.
☆ロタウイルスの分子疫学
ロタウイルスは、小児下痢症の主要原因ウイルスとして知られています。ウイルス構造タンパク質の一つであるVP6の抗原性によりA~H群に分類され、そのうち臨床的にはA群(ロタウイルスA)が重要です。さらにロタウイルスAはVP7によって決定させるG血清型と、VP4によって決定されるP遺伝子型が存在します。ウイルスゲノムとしては11分節の2本鎖RNAを持ち、各遺伝子にGx-P[x]-Ix-Rx-Cx-Mx-Ax-Nx-Tx-Ex-Hx遺伝子型を対応させ表記します。ロタウイルスゲノムには多様性があり、特に遺伝子分節の再集合(genetic reassortant)によって大きく変化します。また、動物のロタウイルスがヒトに感染(種間伝播)することが稀に起こることが知られています。その場合でも通常はヒトに適応して増殖することはほとんどないと考えられていますが、ヒトのロタウイルスとの間で遺伝子分節を交換し、genetic reassortantとしてヒトに適合して生存しているウイルスの存在が示唆されています。我々は、海外(ネパール等)との共同研究により、上記のようなロタウイルスの自然環境における多様性とその進化過程の解析を行っています。
<代表論文>
Takatsuki H, Agbemabiese CA, Nakagomi T, Pun SB, Gauchan P, Muto H, Masumoto H, Atarashi R, Nakagomi O, Pandey BD. Whole genome characterisation of G11P[25] and G9P[19] rotavirus A strains from adult patients with diarrhoea in Nepal. Infect Genet Evol. 2019;69:246-254.