固定液調製法 Fixative solution
パラフィン切片試料作製に用いる固定液の作製法をご紹介します。
通常、光学顕微鏡観察で用いられるパラフィン切片試料作製では「4% パラフォルムアルデヒド/0.1M リン酸緩衝液(pH 7.4)」の組成が標準的に使用されます。
8% パラフォルムアルデヒド溶液調製
約90 mlの蒸留水にパラフォルムアルデヒド粉末8 gを溶解後、蒸留水を加えて100 mlとします。パラフォルムアルデヒドは溶解しにくいため、100 ml当たり2〜3滴の1N NaOHを添加し、60〜70℃のホットプレート付スターラーで攪拌します。
蒸気が角膜や咽頭を刺激しないよう、ドラフトチャンバー内でアルミホイルで蓋をして攪拌します。約20分間の攪拌で溶解した後、念のためフィルターペーパーを通して濾過します。

4% パラフォルムアルデヒド/0.1M リン酸緩衝液, pH 7.4調製
最終容量 100 ml 当たり
8% パラフォルムアルデヒド 50 ml/0.4M リン酸緩衝液(pH 7.4)25 ml/蒸留水 25 ml
※ 注) ストック用の0.4M リン酸緩衝液を冷蔵保存すると、微細なリン酸結晶物が形成されて観察の妨げとなるため、室温で保管して下さい。
血管内灌流固定法
Fixation by vascular perfusion
灌流固定はマウスやラットなどの小動物に麻酔をかけた状態で、心臓の左心室から固定液を注入するもので、手技に一定の熟練を要しますが、細胞や組織が生きた状態で固定液が末梢血管に行き渡ることから、良好な固定条件を得ることができます。
ラット1匹当たりの溶液量
生理食塩水 100 ml/固定液 100 ml(血管内灌流用)/固定液 60 ml (追加浸漬固定用)
はじめに点滴台にかけた2つの容器に生理食塩水(容器A)と固定液(容器B)を入れ、チューブ内の空気を除いた後、三方活栓を操作して容器Aから生理食塩水が流れ出る状態にしてストッパーをかけておきます。
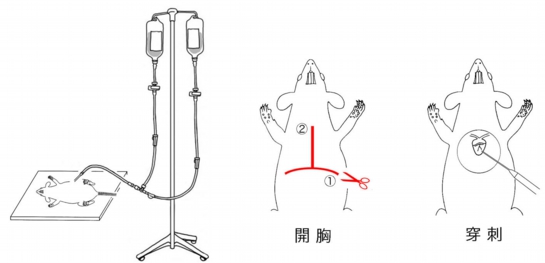
麻酔が十分に効いていることを確認した後、上図の切開線に沿って開胸します。
続いて、拍動する心臓の心尖部から左心室に注射針(18G)を穿刺し(注射針の先端が左心室を突き抜けず、心室内に位置するように注意)、注射針が抜けないよう鉗子などで心筋の上から挟み留めます。次に血液と灌流液を排出するため、右心房の一部を切開し、直ちにストッパーを開放して生理食塩水を注入します。
血液の排出が進むにつれ、肝臓が赤色からピンク色に変化し、右心房から排出される液が透明化していきます。約30秒が経過して、十分に血液が排出されたことを確認した後、三方活栓を切り換えて固定液を注入します。
固定液が環流すると筋肉が収縮し、次第に固定が進行していきます。ラット1匹あたり80〜100 mlの固定液を環流し、注射針を抜去した後、観察を行う臓器・組織を切除し、1 〜 2 cm 四方程度に細切して追加浸漬固定液に浸します。

光学顕微鏡用試料サイズ
室温で約2時間または冷蔵で一晩、追加浸漬固定後、固定液を0.1M リン酸緩衝液に置き換えて冷蔵保存し、必要に応じて次の試料作製行程へ進みます(数ヶ月間、保存可能)。
マウス1匹当たりの溶液量
生理食塩水 40 ml/固定液 40 ml(血管内灌流用)/固定液 30 ml (追加浸漬固定用)
マウスの場合は21Gまたは23Gの注射針を使用し、点滴台の代わりに生理食塩水と固定液を別々に充填した50 mlシリンダを差し替えて注入する変法をとることが出来ます。
浸漬固定法
Immersion into fixative solution
浸漬固定はヒトの試料をはじめ、灌流固定を施せない大型動物の臓器などから小さく切り出した試料を、固定液に浸漬して細胞や組織を固定する方法です。
試料の切り出しから固定液への浸漬までの行程を迅速に行い、死後変化に伴う人工修飾を如何に抑えるかがカギとなります。なお、培養細胞も浸漬固定の対象となりますが、培養液を固定液に入れ替えるだけですから、死後変化の影響を受ける心配はありません。